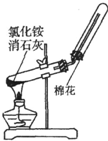
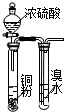
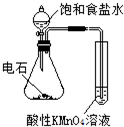
题目内容
11.标准状况下,112mL某气体的质量为0.15g,则其摩尔质量是30g/mol,相对分子质量是30.分析 依据标准状况气体物质的量n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$计算,相对分子质量在数值上等于其摩尔质量.
解答 解:标况下,112mL某气体的质量为0.15g,其物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{0.112L}{22.4L/mol}$=0.005mol,故其摩尔质量=M=$\frac{m}{n}$=$\frac{0.15g}{0.005mol}$=30g/mol,相对分子质量在数值上等于其摩尔质量,相对分子质量为30,
故答案为:30g/mol;30.
点评 本题考查了摩尔质量、气体摩尔体积的概念计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
1.根据热化学方程式(在101kPa下):S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1分析下列说法,其中不正确的是( )
| A. | 该条件下32g S(s)完全燃烧放出的热量为297.23kJ | |
| B. | 反应S(g)+O2(g)═SO2(g)的△H大于-297.3kJ•mol-1 | |
| C. | 反应S(g)+O2(g)═SO2(g)的△H小于-297.3kJ•mol-1 | |
| D. | 形成1 mol SO2(g)中的化学键所释放的总能量大于断裂1 mol S(s)和1mol O2(g)中的化学键所吸收 |
6.三甲基铝(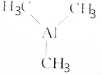 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )
 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )| A. | 三甲基铝的摩尔质量是72 | |
| B. | 14.4g三甲基铝中碳原子数为0.6NA | |
| C. | 0.5mol三甲基铝的质量为36g•mol-1 | |
| D. | 1mol三甲基铝在标准状况下的体积约为22.4L |
5. 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
12.在下列溶液中,一定能大量共存的离子组是( )
| A. | 常温下$\frac{c({H}^{+})}{c({OH}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、Cl-、HCO3- | |
| C. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 常温下,由水电离出的c(H+)=1×10-13 mol•L-1的溶液中:K+、Fe3+、CH3COO-、SO42-电解 |
9.在下列各组物质中,互为同分异构体的是( )
| A. | 甲烷与丙烷 | B. | 1H与2H | C. | O2与O3 | D. | 正丁烷与异丁烷 |