题目内容
14.松花蛋于明朝初年问世.其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl).将一定比例的配料用水和粘土调制成糊状,敷于蛋上,密封保存,数日后可食用.(1)腌制皮蛋配料用水调制时,主要发生化学反应的方程式有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)皮蛋外的糊状物经溶解、过渡后,所得滤液中肯定大量含有的物质为NaCl和NaOH,可能含有的物质为Ca(OH)2或Na2CO3.
(3)某学生设计如表示的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮助他完成实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液,滴加过量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| ②取少量滤液, 滴入过量盐酸 | 若出现 气泡 | 滤液中含Na2CO3 |
| 若无现象 | 滤液中无Na2CO3 |
分析 (1)根据水和生石灰反应生成氢氧化钙;纯碱和氢氧化钙反应生成碳酸钙和氢氧化钠进行解答;
(2)根据主要配料中含氯化钠,反应生成氢氧化钠,两种都易溶于水进行解答;
(3)Ca(OH)2 易与K2CO3溶液反应生成沉淀,Na2CO3与盐酸反应生成气体.
解答 解:(1)腌制松花蛋的配料有生石灰,加入水发生反应生成氢氧化钙,化学反应的方程式:CaO+H2O=Ca(OH)2;生成的Ca(OH)2与纯碱发生生成碳酸钙沉淀和氢氧化钠,化学反应的方程式:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
故答案为:CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)配料中的食盐和生成的NaOH易溶于水,则滤液中肯定大量含有的溶质为NaCl和NaOH.
故答案为:NaCl;NaOH;
(3)②Na2CO3与盐酸反应生成气体,取少量滤液,加入过量盐酸,如有气泡生成,则说明含有Na2CO3,如无气泡生成,则说明没有Na2CO3.
故答案为:②加入足量的盐酸;气泡.
点评 本题考查元素化合物的性质以及物质的检验,题目难度不大,学习中注意把握相关基础知识的积累.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
4.如图表示反应:A(g)+B(g)?nC(g)△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )

| A. | a表示有催化剂,b表示无催化剂 | B. | 若其他条件相同,a比b的温度高 | ||
| C. | 反应由逆反应开始 | D. | a→b采用的是加压 |
5.下列物质露置在空气中容易变质的是( )
| A. | Na | B. | SiO2 | C. | NaCl | D. | K2SO4 |
2.下列物质分类正确的是( )
| A. | Cu(OH)2难溶于水,属于非电解质 | |
| B. | SO2能与碱反应生成盐和水,属于酸性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | HCl气体溶于水电离成H+和Cl-,属于离子化合物 |
9.分类是化学研究中常用的方法,下列分类说法中正确的是( )
| A. | 电离产生阳离子全部是H+化合物叫酸,根据其分子中氢原子的个数确定该酸的元数 | |
| B. | 依据组成元素的种类,将纯净物分为单质和化合物 | |
| C. | 根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物 | |
| D. | 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液 |
19.下列操作过程中实验现象的变化只有一次的是( )
| A. | 石蕊试液中逐滴滴加氯水 | B. | 酚酞试液中加入过氧化钠固体 | ||
| C. | 氢氧化铁胶体中逐滴滴加硫酸 | D. | 碳酸钠溶液中逐滴滴加盐酸 |
3.下列说法正确的是( )
| A. | 含碳元素的化合物都是有机物 | |
| B. | 完全燃烧只生成 CO2和 H2O 的化合物都是烃 | |
| C. | 有机物完全燃烧只可能生成 CO2 和 H2O | |
| D. | 点燃混有空气的甲烷不一定会爆炸 |


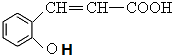 +CH3I→
+CH3I→ +HI,该反应类型为取代反应,该反应步骤的目的是保护酚羟基,使之不被氧化.
+HI,该反应类型为取代反应,该反应步骤的目的是保护酚羟基,使之不被氧化.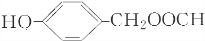 或
或 .
. 合成
合成  (用反应流程图表示,并注明反应条件).
(用反应流程图表示,并注明反应条件).