题目内容
胃酸的主要成分是稀盐酸,胃酸过多会引起很多的疾病.小苏打(主要成分为NaHCO3)是常用的中和胃酸的药物(1)写出小苏打中和胃酸的离子方程式: .
(2)小苏打片每片含0.42gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是 mol,反应后放出的CO2在标准状况体积为 mL.
(2)小苏打片每片含0.42gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是
考点:钠的重要化合物
专题:元素及其化合物
分析:(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
(2)依据离子方程式H++HCO3-=H2O+CO2↑计算解答.
(2)依据离子方程式H++HCO3-=H2O+CO2↑计算解答.
解答:
解:(1)碳酸氢钠与盐酸反应的离子方程式为:H++HCO3-=H2O+CO2↑;
故答案为:H++HCO3-=H2O+CO2↑;
(2)0.42gNaHCO3,的物质的量为n=
=0.005mol,则两片小苏打片含碳酸氢钠的物质的量为0.005mol×2=0.01mol,由离子方程式得:
H++HCO3-=H2O+CO2↑
1 1 22400ml
n(H+)0.01mol V
n(H+)=0.01mol;
V=
=224ml;
所以消耗氢离子的物质的量为:0.01 mol;反应后放出的CO2在标准状况体积为224ml;
故答案为:0.01;224.
故答案为:H++HCO3-=H2O+CO2↑;
(2)0.42gNaHCO3,的物质的量为n=
| 0.42g |
| 84g/mol |
H++HCO3-=H2O+CO2↑
1 1 22400ml
n(H+)0.01mol V
n(H+)=0.01mol;
V=
| 22400ml×0.01 |
| 1 |
所以消耗氢离子的物质的量为:0.01 mol;反应后放出的CO2在标准状况体积为224ml;
故答案为:0.01;224.
点评:本题考查了碳酸氢钠的性质及相关计算,题目难度不大,准确书写离子方程式,依据方程式即可解答.

练习册系列答案
相关题目
下列物质的电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
下列离子方程式中正确的是( )
| A、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+=3Fe3++4H2O |
| C、用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| D、CH3COOH溶液与NaOH溶液反应:H++OH-=H2O |
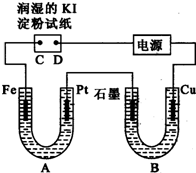 电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:

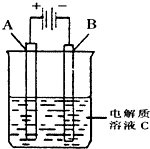 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.