题目内容
(已知M(Mg)=24g?mol-1,Vm=22.4L?mol-1,今有0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积V(H2).
(1)缺少的一个数据a是 (要求指出该数据的名称、符号和单位).
(2)写出计算式:① ;
② .
(1)缺少的一个数据a是
(2)写出计算式:①
②
考点:物质的量浓度的相关计算,数据缺省型的计算
专题:物质的量浓度和溶解度专题
分析:(1)不能确定金属是否完全反应,需要知道盐酸的物质的量浓度;
(2)讨论过量问题进行解答,若盐酸足量,Mg完全反应,根据Mg计算氢气体积,若Mg有剩余,盐酸不足,根据盐酸计算氢气的体积,根据Mg与盐酸恰好反应确定盐酸浓度.
(2)讨论过量问题进行解答,若盐酸足量,Mg完全反应,根据Mg计算氢气体积,若Mg有剩余,盐酸不足,根据盐酸计算氢气的体积,根据Mg与盐酸恰好反应确定盐酸浓度.
解答:
解:(1)不能确定金属是否完全反应,需要知道盐酸的物质的量浓度amol?L-1,
故答案为:盐酸的物质的量浓度amol?L-1;
(2)0.48g Mg的物质的量=
=0.02mol,由Mg+2HCl=MgCl2+H2↑,可知Mg与HCl恰好时,n(HCl)=0.02mol×2=0.04mol,c(HCl)=
=0.4mol/L,
当c(HCl)≥4mol?L-1时,盐酸足量,Mg完全反应,则n(H2)=n(Mg)=0.02mol,故V(H2)=0.02mol×22.4L/mol=0.448L;
当c(HCl)<4mol?L-1时,Mg有剩余,盐酸不足,n(H2)=
n(HCl)=0.01L×amol/L=0.005a mol,故V(H2)=0.005 amol×22.4L/mol=0.112L,
故答案为:当c(HCl)≥4mol?L-1时V(H2)=0.448L;当c(HCl)<4mol?L-1时,V(H2)=0.112aL.
故答案为:盐酸的物质的量浓度amol?L-1;
(2)0.48g Mg的物质的量=
| 0.48g |
| 24g/mol |
| 0.04mol |
| 0.1L |
当c(HCl)≥4mol?L-1时,盐酸足量,Mg完全反应,则n(H2)=n(Mg)=0.02mol,故V(H2)=0.02mol×22.4L/mol=0.448L;
当c(HCl)<4mol?L-1时,Mg有剩余,盐酸不足,n(H2)=
| 1 |
| 2 |
故答案为:当c(HCl)≥4mol?L-1时V(H2)=0.448L;当c(HCl)<4mol?L-1时,V(H2)=0.112aL.
点评:本题考查化学方程式的有关计算,侧重考查过量计算,难度不大,根据恰好反应确定盐酸的浓度.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
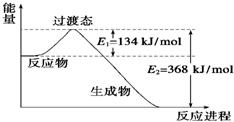 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: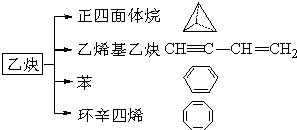 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: