题目内容
6.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备.回答下列问题:(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g)△H1
已知:②C4H10(g)+$\frac{1}{2}$O2(g)=C4H8(g)+H2O(g)△H2=-119kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3 =-242kJ•mol-1
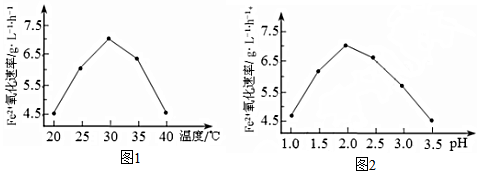
反应①的△H1为+123 kJ•mol-1.图(a)是反应①平衡转化率与反应温度及压强的关系图,x小于0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是AD(填标号).
A.升高温度B.降低温度C.增大压强D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等.图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系.图中曲线呈现先升高后降低的变化趋势,其降低的原因是原料中过量H2会使反应①平衡逆向移动,所以丁烯产率下降.
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物.丁烯产率在590℃之前随温度升高而增大的原因可能是升高温度时,反应速率加快,单位时间内产生丁烯更多、590℃前升高温度,反应①平衡正向移动;590℃之后,丁烯产率快速降低的主要原因可能是高温则有更多的丁烷裂解生成副产物导致产率降低.
分析 (1)根据盖斯定律,②式-③式可得①式的△H1;
由a图定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;
要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;
(2)丁烷分解产生丁烯和氢气,增加氢气的量会促使平衡逆向移动,丁烯的产率下降;
(3)升温速率加快,单位时间内生成丁烯更多,升温反应①平衡正向移动,丁烯产率增加;
由题中信息可知丁烷高温会裂解生成短链烃类,所以当温度超过590℃时,部分丁烷裂解导致产率降低.
解答 解:(1)②C4H10(g)+$\frac{1}{2}$O2(g)=C4H8(g)+H2O(g)△H2=-119kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1
②-③得C4H10(g)=C4H8(g)+H2(g)△H1=+123kJ•mol-1
由a图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;
由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①正向进行时体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,
故答案为:+123;小于;AD;
(2)丁烷分解产生丁烯和氢气,一开始充入氢气是为活化催化剂,同时氢气作为反应①的产物,增大氢气的量会促使平衡逆向移动,从而减少平衡体系中的丁烯的含量,使丁烯的产率降低,
故答案为:原料中过量H2会使反应①平衡逆向移动,所以丁烯产率下降;
(3)590℃之前,温度升高时反应速率加快,单位时间内生成的丁烯会更多,同时由于反应①是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯;
而温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少,产率下降,
故答案为:升高温度时,反应速率加快,单位时间产生丁烯更多;590℃前升高温度,反应①平衡正向移动;高温则有更多的丁烷裂解生成副产物导致产率降低.
点评 本题考查盖斯定律以及化学平衡的影响因素,为高频考点,把握图象分析温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意化学平衡在实际生产中的应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 可用于制备苏打 | B. | 可用于糕点生产中 | ||
| C. | 与H+作用易产生CO2 | D. | 可用饱和食盐水与CO2反应制得 |
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )| A. | Ts是第七周期第ⅦA族元素 | |
| B. | Ts的同位素原子具有相同的电子数 | |
| C. | Ts在同族元素中非金属性最弱 | |
| D. | 中子数为176的Ts核素符号是${\;}_{117}^{176}$Ts |
| A. | 用石灰、碳酸钠等碱性物质处理废水中的酸 | |
| B. | 用可溶性的铝盐和铁盐处理水中的悬浮物 | |
| C. | 用氯气处理水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用烧碱处理含高浓度NH4+的废水并回收利用氨 |
| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
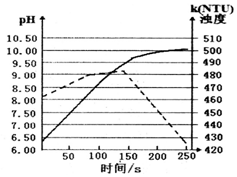 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )| A. | 该实验是在常温下进行的 | |
| B. | 实线表示溶液浊度随时间的变化 | |
| C. | 50s时向溶液中滴入酚酞试液,溶液变红 | |
| D. | 150s后溶液浊度下降是因为生成的Mg(OH)2沉降 |



 .
. .
. ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是
;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是 .
. 路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).