题目内容
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和
O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、燃料电池的能量转化率可达100% |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答:
解:A、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故A错误;
B、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故B正确;
C、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,无污染,属于环境友好电池,故C正确;
D、氢氧燃料电池在将化学能转化为电能的同时,还会伴随其他形式能的转化,故D错误.
故选BC.
B、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故B正确;
C、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,无污染,属于环境友好电池,故C正确;
D、氢氧燃料电池在将化学能转化为电能的同时,还会伴随其他形式能的转化,故D错误.
故选BC.
点评:本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在同温同压下,某瓶充满O2时质量为116g,充满CO2时质量为122g,充满气体X时质量为121g,则X的相对分子质量为( )
| A、32 | B、40 | C、42 | D、44 |
联苯( )由两个苯环通过单键连接而成,假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有( )
)由两个苯环通过单键连接而成,假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有( )
 )由两个苯环通过单键连接而成,假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有( )
)由两个苯环通过单键连接而成,假定二氯联苯分子中,苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有( )| A、6种 | B、9种 |
| C、10种 | D、12种 |
下列反应的离子方程式正确的是( )
| A、碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O |
| B、向(NH4)2SO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
| C、铜与稀硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O |
| D、盐酸滴入氨水中:H++OH-=H2O |
下列气体均有毒,使人中毒的原理与CO相似的是( )
| A、Cl2 |
| B、SO2 |
| C、NO |
| D、NO2 |
某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为52.24%,其余为氧,该化合物分子中最多可以含多少个 结构( )
结构( )
 结构( )
结构( )| A、1个 |
| B、2 个 |
| C、3 个 |
| D、4个 |
某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度.下列叙述正确的是( )
| A、恢复到原温度后,溶液的浓度增大 |
| B、沉淀物的质量为7.4g |
| C、饱和石灰水的质量大于98.2g |
| D、恢复到原温度后,溶液的质量分数不变 |
俗话说“雷雨发庄稼”.在雷雨天,空气中有O3(由O2生成)和NO产生,下列说法正确的是( )
| A、O3和O2两种气体都是氧元素形成的单质,化学性质相同 |
| B、生成O3和NO的反应都是氧化还原反应 |
| C、NO在空气中不能稳定存在,会继续反应 |
| D、NO的产生是形成酸雨的主要原因 |
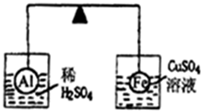 在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )| A、铝球一定是空心的 |
| B、左边烧杯中的溶液质量减少了 |
| C、去掉两烧杯杠杆仍平衡 |
| D、右边铁球上出现红色 |