题目内容
俗话说“雷雨发庄稼”.在雷雨天,空气中有O3(由O2生成)和NO产生,下列说法正确的是( )
| A、O3和O2两种气体都是氧元素形成的单质,化学性质相同 |
| B、生成O3和NO的反应都是氧化还原反应 |
| C、NO在空气中不能稳定存在,会继续反应 |
| D、NO的产生是形成酸雨的主要原因 |
考点:氮的氧化物的性质及其对环境的影响
专题:氮族元素
分析:A、O3和O2两种气体都是氧元素的同素异形体,化学性质相同;
B、生成臭氧的反应是同素异形体相互转化,无元素化合价变化;
C、一氧化氮和空气中氧气反应生成二氧化氮;
D、二氧化硫是形成酸雨的主要原因.
B、生成臭氧的反应是同素异形体相互转化,无元素化合价变化;
C、一氧化氮和空气中氧气反应生成二氧化氮;
D、二氧化硫是形成酸雨的主要原因.
解答:
解:A、O3和O2两种气体都是氧元素的同素异形体,化学性质不同,故A正确;
B、生成臭氧的反应是同素异形体相互转化,3O2=2O3,无元素化合价变化,不是氧化还原反应,故B错误;
C、一氧化氮和空气中氧气反应生成二氧化氮,NO在空气中不能稳定存在,会继续反应,故C正确;
D、二氧化硫是形成酸雨的主要原因,故D错误;
故选C.
B、生成臭氧的反应是同素异形体相互转化,3O2=2O3,无元素化合价变化,不是氧化还原反应,故B错误;
C、一氧化氮和空气中氧气反应生成二氧化氮,NO在空气中不能稳定存在,会继续反应,故C正确;
D、二氧化硫是形成酸雨的主要原因,故D错误;
故选C.
点评:本题考查了氮及其化合物性质分析判断,注意氧化还原反应分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法正确的是( )
A、按系统命名法,化合物 的名称为2,7,7-三甲基-4,4-二乙基辛烷 的名称为2,7,7-三甲基-4,4-二乙基辛烷 |
| B、在蛋白质分子中存在氨基和羧基,可通过调节溶液的pH使其形成晶体析出 |
C、1mol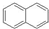 完全燃烧.消耗氧气的量为1mol 完全燃烧.消耗氧气的量为1mol 的2倍 的2倍 |
D、香芹酮的结构为: ,1mol的香芹酮最多能和2mol的氢气反应 ,1mol的香芹酮最多能和2mol的氢气反应 |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和
O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、燃料电池的能量转化率可达100% |
下列物质能发生消去反应的是( )
① ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
①
 ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.| A、①⑤ | B、②③④⑥⑦ |
| C、②③④⑥ | D、②③④ |
在用电石制乙炔的实验中,不能用来除杂的溶液是( )
| A、CuSO4 |
| B、NaOH |
| C、CuCl2 |
| D、KMnO4 |
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、已知,N2(g)+3 H2(g)?2NH3(g)△H<0,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是( )
| A、①② | B、①③ | C、④⑤ | D、②④ |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氢气中1mol H-H 键完全断裂时吸收热量436kJ,水蒸气中1mol H-O 键形成时放出热量463kJ,则氧气中1mol O=O 键断裂时吸收热量为( )
| A、188kJ |
| B、248 kJ |
| C、124kJ |
| D、496kJ |
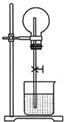 如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )
如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )| A、NH3 |
| B、NO2和H2O |
| C、CO2和NaOH溶液 |
| D、4:1的NO2与O2和水 |