题目内容
下列反应的离子方程式正确的是( )
| A、碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O |
| B、向(NH4)2SO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
| C、铜与稀硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O |
| D、盐酸滴入氨水中:H++OH-=H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸钙在离子反应中保留化学式;
B.漏写铵根离子与碱的反应;
C.反应生成硝酸铜、NO和水;
D.一水合氨在离子反应中保留化学式.
B.漏写铵根离子与碱的反应;
C.反应生成硝酸铜、NO和水;
D.一水合氨在离子反应中保留化学式.
解答:
解:A.碳酸钙溶解于稀硝酸中的离子反应为2H++CaCO3=H2O+CO2↑+Ca2+,故A错误;
B.向(NH4)2SO4溶液中滴加Ba(OH)2溶液的离子反应为2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3?H2O,故B错误;
C.铜与稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,遵循电子、电荷守恒,故C正确;
D.盐酸滴入氨水中的离子反应为H++NH3?H2O=H2O+NH4+,故D错误;
故选C.
B.向(NH4)2SO4溶液中滴加Ba(OH)2溶液的离子反应为2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3?H2O,故B错误;
C.铜与稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,遵循电子、电荷守恒,故C正确;
D.盐酸滴入氨水中的离子反应为H++NH3?H2O=H2O+NH4+,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
已知:
2H2O(l)=2H2(g)+O2(g);△H=+571.6kJ
CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-890.3kJ,
1克氢气和1克甲烷分别燃烧后,放出的热量之比约是( )
2H2O(l)=2H2(g)+O2(g);△H=+571.6kJ
CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-890.3kJ,
1克氢气和1克甲烷分别燃烧后,放出的热量之比约是( )
| A、1:3.4 |
| B、1:1.7 |
| C、2.6:1 |
| D、4.6:1 |
下列说法正确的是( )
A、按系统命名法,化合物 的名称为2,7,7-三甲基-4,4-二乙基辛烷 的名称为2,7,7-三甲基-4,4-二乙基辛烷 |
| B、在蛋白质分子中存在氨基和羧基,可通过调节溶液的pH使其形成晶体析出 |
C、1mol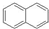 完全燃烧.消耗氧气的量为1mol 完全燃烧.消耗氧气的量为1mol 的2倍 的2倍 |
D、香芹酮的结构为: ,1mol的香芹酮最多能和2mol的氢气反应 ,1mol的香芹酮最多能和2mol的氢气反应 |
分子式为C3H8O 的醇与分子式为C4H8O2的酸在浓硫酸存在时共热生成的酯有( )
| A、6种 | B、5种 | C、4种 | D、3种 |
下列各项的变化中,放出热量的是( )
①钠与盐酸反应;②生石灰与水反应;③浓硫酸滴入水中;④烧碱溶于水.
①钠与盐酸反应;②生石灰与水反应;③浓硫酸滴入水中;④烧碱溶于水.
| A、①③ | B、③ |
| C、①②③④ | D、①②③ |
下列排列顺序正确的是( )
①固体的热稳定性:CaCO3>Na2CO3>NaHCO3;
②还原性:SO32->I->Br-;
③微粒半径:K+>Na+>O2-;
④结合H+的能力:OH->AlO2->HCO3-;
⑤氢化物的沸点:H2O>NH3>HF.
①固体的热稳定性:CaCO3>Na2CO3>NaHCO3;
②还原性:SO32->I->Br-;
③微粒半径:K+>Na+>O2-;
④结合H+的能力:OH->AlO2->HCO3-;
⑤氢化物的沸点:H2O>NH3>HF.
| A、①③ | B、②④ | C、①② | D、③⑤ |
氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和
O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、燃料电池的能量转化率可达100% |
下列物质能发生消去反应的是( )
① ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
①
 ②
② ③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.
③1丁醇 ④CHCl2CHBr2 ⑤2,2二甲基1丙醇 ⑥环己醇 ⑦(CH3)3CCH2Cl.| A、①⑤ | B、②③④⑥⑦ |
| C、②③④⑥ | D、②③④ |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氢气中1mol H-H 键完全断裂时吸收热量436kJ,水蒸气中1mol H-O 键形成时放出热量463kJ,则氧气中1mol O=O 键断裂时吸收热量为( )
| A、188kJ |
| B、248 kJ |
| C、124kJ |
| D、496kJ |