题目内容
4.下列对分子及其性质的解释中,不正确的是( )| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
分析 A.极性分子易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂;
B.根据手性异构体分子的概念、结构和性质分析;
C.含有孤电子对的微粒与含有空轨道的微粒易形成配合物;
D.酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强.
解答 解:A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸 中第二个C为手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故B正确;
中第二个C为手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子,故B正确;
C.含有孤电子对的微粒与含有空轨道的微粒易形成配合物,因而,不仅是过渡金属才能形成配合物,故C错误;
D.H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数,所以磷酸的酸性大于次氯酸,故D正确;
故选:C.
点评 本题考查了氢键、手性碳原子、分子稳定性的判断等知识点,题目难度不大,注意手性碳原子的判断方法:碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
14.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)$→_{催化剂}^{150℃}$2N2(g)+3H2O(g)△H<0,在恒容的密闭容器中,下列有关说法不正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率增大 | |
| C. | 单位时间内消耗NO和N2的物质的量比为1:1时,反应达到平衡 | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率不变 |
12.核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是( )
| A. | 核反应发电实现了化学能到电能的转化 | |
| B. | 115 号元素一定是处于VA 族的非金属元素 | |
| C. | 117 号元素与F、Cl、Br、I 均处于VIIA 族 | |
| D. | 四种新元素位于元素周期表中的不同周期 |
19.元素的性质呈周期性变化的根本原因是( )
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
9.下列化学用语正确的是( )
| A. | 氯离子结构示意图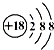 | B. | HCl的电子式 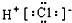 | ||
| C. | CO2的结构式 O=C=O | D. | 作为相对原子质量标准的原子614C |
16.下列说法错误的是( )
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
13.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是( )
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b+2}$R |
15.下列物质的性质比较,正确的是( )
| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |