题目内容
2.实验室利用反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,以溶液变浑浊时间的长短来研究影响化学反应速率的因素,下列各组实验中化学反应速率最大的是组号反应( )| 组号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O的体积(mL) | ||||
| 体积(mL) | 浓度(mol•L-1) | 体积(mL) | 浓度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
分析 对于反应Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O来说,升高温度,增大浓度,可增大反应速率,以此解答.
解答 解:温度越高,反应物浓度越大,则反应速率越大,比较题中四组数据可知D的温度最高、反应物浓度最大,则反应速率最大.
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
12.新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”. 关于苹果褐变的原因有以下两种说法:
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
(2)探究2:
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
(3)问题分析:
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
7.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
11.某无色溶液加入铝可以生成氢气,则在该溶液中不可能大量存在的离子组是( )
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
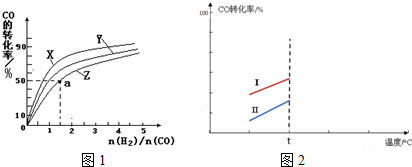
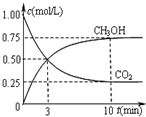 工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.
工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.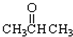 ③CH3CH2Br ④
③CH3CH2Br ④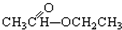 ⑤
⑤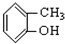 ⑥
⑥ ⑦
⑦ ⑧
⑧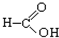 ⑨
⑨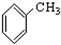 ⑩
⑩