题目内容
7.有机物A、B的分子式均为C11H12O5,均能发生如下变化.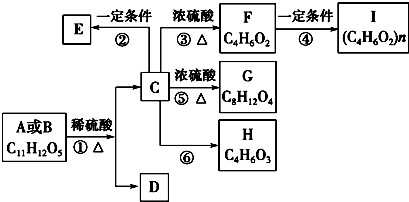
已知:①A、B、C、D均能与NaHCO3反应;
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种;
③F能使溴水褪色且不含有甲基;
④H能发生银镜反应.
根据题意回答下列问题.
(1)反应③的反应类型消去;反应⑥的条件是Cu、加热.
(2)写出F的结构简式CH2=CHCH2COOH;D中含氧官能团的名称是羟基和羧基.
(3)E是C的缩聚产物,写出反应②的化学方程式
 .
.(4)下列关于A~I的说法中正确的是bd(选填编号).
a.I的结构简式为
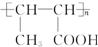
b.D在一定条件下也可以反应形成高聚物
c.G具有8元环状结构
d.等质量的A与B分别与足量NaOH溶液反应,消耗等量的NaOH
(5)写出B与足量NaOH溶液共热的化学方程式:
 .
.(6)D的同分异构体有很多种,写出同时满足下列要求的其中一种同分异构体的结构简式:
 .
.①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种.
分析 A、B、C、D均能与NaHCO3反应,说明都含有羧基-COOH,F能使溴水褪色且不含有甲基,结合分子式可知为CH2=CHCH2COOH,H能发生银镜反应,应含有醛基,则C应为HOCH2CH2CH2COOH,H为OHCCH2CH2COOH.只有A、D能与FeCl3溶液发生显色反应,说明分子中含有酚羟基,且A的苯环上的一溴代物只有两种,则结构应对称,且含有2个取代基,A应为 ,B为
,B为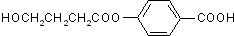 ,D为
,D为 ,结合对应有机物的结构和性质以及题目要求可解答该题.
,结合对应有机物的结构和性质以及题目要求可解答该题.
解答 解:A、B、C、D均能与NaHCO3反应,说明都含有羧基-COOH,F能使溴水褪色且不含有甲基,结合分子式可知为CH2=CHCH2COOH,H能发生银镜反应,应含有醛基,则C应为HOCH2CH2CH2COOH,H为OHCCH2CH2COOH.只有A、D能与FeCl3溶液发生显色反应,说明分子中含有酚羟基,且A的苯环上的一溴代物只有两种,则结构应对称,且含有2个取代基,A应为 ,B为
,B为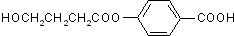 ,D为
,D为 ,
,
(1)C为HOCH2CH2CH2COOH,发生消去反应生成F,C含有羟基,在铜作催化剂条件下加热发生氧化反应生成H,
故答案为:消去;Cu、加热;
(2)由以上分析可知F为CH2=CHCH2COOH,D为 ,含有的官能团为羧基和羟基,
,含有的官能团为羧基和羟基,
故答案为:CH2=CHCH2COOH;羟基和羧基;
(3)反应②为缩聚反应,反应的化学方程式为 ,
,
故答案为: ;
;
(4)a、F为CH2=CHCH2COOH,发生聚合反应生成I,I为 ,故a错误;
,故a错误;
b、D为 ,可以通过酯化反应进行的缩聚反应形成高聚物,故b正确;
,可以通过酯化反应进行的缩聚反应形成高聚物,故b正确;
c、生成G脱去2分子水,应为10元环状结构,故c错误;
d、A为 ,B为
,B为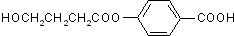 ,二者互为同分异构体,等质量的A与B,物质的量相等,每摩尔物质都消耗3molNaOH,故d正确;
,二者互为同分异构体,等质量的A与B,物质的量相等,每摩尔物质都消耗3molNaOH,故d正确;
故答案为:bd;
(5)B为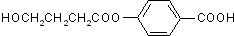 ,与足量氢氧化钠反应的方程式为
,与足量氢氧化钠反应的方程式为 ,
,
故答案为: ;
;
(6)D为 ,对应的同分异构体中①与FeCl3溶液发生显色反应,说明含有酚羟基,②发生银镜反应,但不能水解,应含有醛基,不含酯基,③苯环上的一卤代物有2种,说明苯环结构中只含有两种性质不同的氢原子,符合条件的有:
,对应的同分异构体中①与FeCl3溶液发生显色反应,说明含有酚羟基,②发生银镜反应,但不能水解,应含有醛基,不含酯基,③苯环上的一卤代物有2种,说明苯环结构中只含有两种性质不同的氢原子,符合条件的有: ,
,
故答案为: .
.
点评 本题考查有机推断与合成,涉及酯、醇、醛等性质以及学生根据信息给予获取知识的能力,是对有机化合物知识的综合考查,能较好的考查考生的阅读、自学能力和思维能力,利用给予的反应信息确定有机物结构是本题关键之处,根据反应条件,利用顺推法进行推断,是高考热点题型,难度中等.

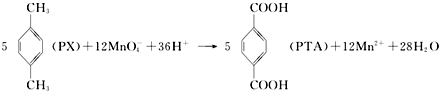
下列有关说法错误的是( )
| A. | PTA是该反应的氧化产物 | |
| B. | PTA与乙二醇通过加聚反应即可生产PET塑料 | |
| C. | PX分子含有苯环的同分异构体还有3种 | |
| D. | 该反应消耗1molPX,共转移10mol电子 |
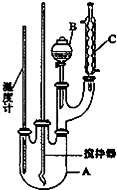 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: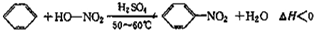
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72.06%.
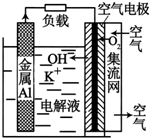 铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )
铝-空气电池以高纯度铝(含铝99.99%)为负极,氧气为正极,以KOH溶液为电解质溶液.如图为某铝-空气电池工作的原理示意图,下列有关说法正确的是( )| A. | 铝-空气电池要及时回收处理,以免造成重金属污染 | |
| B. | 每消耗1molAl,电解质溶液中会有3 mol电子通过 | |
| C. | 负极上的电极反应式为:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 电池总反应式为:Al+KOH+O2═KAlO2+H2O |
| A. | c(CO32-) | B. | c(Mg2+) | C. | c(H+) | D. | Ksp(MgCO3) |
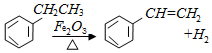 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2、CCl4鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
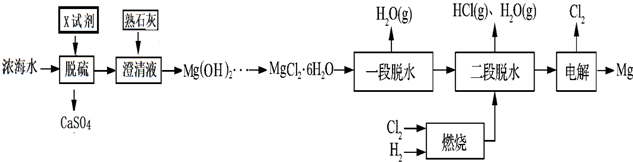
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是SO42-.在上述流程中,可以循环使用的物质是Cl2、HCl.
(2)在该工艺过程中,X试剂的化学式为CaCl2.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为82080g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4•Li2O 该电池的正极反应式为V2O5+2Li++2e-=V2O4•Li2O.
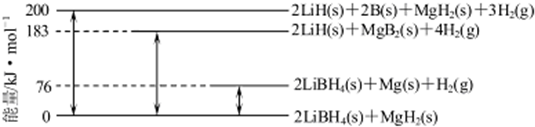
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s) MgB2(s)△H=-93kJ/mol.
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
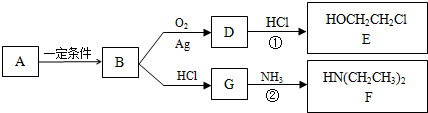
 $\stackrel{还原}{→}$
$\stackrel{还原}{→}$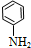 )
)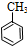 (甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$
(甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$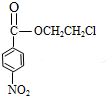 $\stackrel{还原}{→}$丙$→_{④}^{F}$
$\stackrel{还原}{→}$丙$→_{④}^{F}$ (普鲁卡因)
(普鲁卡因)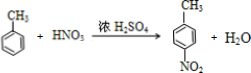 .反应③的化学方程式是(乙中有两种含氧官能团):
.反应③的化学方程式是(乙中有两种含氧官能团):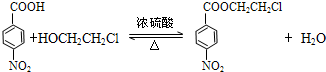 .
.