题目内容
2.随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如图所示.下列说法错误的是( )
| A. | y在元素周期表的位置是第二周期IVA族 | |
| B. | d元素常见离子的半径大于f元素常见离子的半径 | |
| C. | x,、z元素能组成一种四原子共价化合物,其电子式可以表示为 | |
| D. | e、f的最高价氧化物对应的水化物可以相互反应 |
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.根据C元素的位置分析;
B.离子核外电子数相同时,原子序数越大,离子半径越小;
C.由H和N元素组成一种四原子共价化合物为NH3;
D.e、f的最高价氧化物对应的水化物分别为NaOH、Al(OH)3.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.C元素在周期表中位置为第二周期IVA族,故A正确;
B.离子核外电子数相同时,原子序数越大,离子半径越小,则离子半径:O2->Al3+,故B正确;
C.由H和N元素组成一种四原子共价化合物为NH3,其电子式为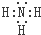 ,故C错误;
,故C错误;
D.e、f的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,氢氧化铝属于两性氢氧化物能与氢氧化钠反应,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
12.在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
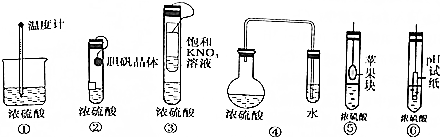

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
13.下列变化中,需加氧化剂才能实现的是( )
| A. | H2O→H2 | B. | FeCl3→FeCl2 | C. | C→CO2 | D. | CaO→Ca(OH)2 |
17.实验是化学研究的基础,关于各实验装置图的叙述中,正确的是( )

| A. | 装置①可用干石油的分馏 | |
| B. | 装置②可用于酒精提取溴水中的Br2 | |
| C. | 装置③可用于吸收HCl气体,并能防止倒吸 | |
| D. | 装置④验证乙烯的生成 |
7.用pH试纸测定某无色溶液的pH时,规范的操作是( )
| A. | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较 | |
| B. | 将溶液倒在pH试纸上,跟标准比色卡比较 | |
| C. | 将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 | |
| D. | 试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
11.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 电池中的重金属等污染土壤,可以回收再利用以减少污染、保护资源 | |
| C. | 人们日常生活中用到各种化学品,应尽量减少甚至不使用 | |
| D. | 城市机动车成为PM2.5(直径≤2.5微米的颗粒物,也称为可入肺颗粒物,有毒、有害)主要源头,必须加以控制 |
12.如表实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |