题目内容
9.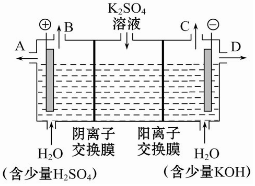 如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑.
分析 阳极发生氧化反应,电解硫酸钾溶液,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极氢氧根离子放电,以此解答该题.
解答 解:电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑.
点评 本题考查电解池原理,为高频考点,侧重考查学生的分析能力,注意把握电解池的工作原理,难度不大,本题注意把握离子的放电顺序.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 形成离子键的阴阳离子键只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 常温下,元素B、D的最高价氧化物对应的水化物之间能发生反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
13.向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
4.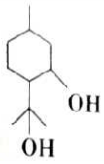 孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )
孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )
 孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )
孟二醇的结构简式如图所示,W是孟二醇的同分异构体,W可水解生成碳原子数相同的两种有机物.下列有关说法正确的是( )| A. | 孟二醇与乙醇属于同系物 | |
| B. | 常温常压下,1mol孟二醇与足量的钠反应可生成22.4LH2 | |
| C. | W的两种水解产物均可与NaHCO3溶液反应放出CO2 | |
| D. | W的结构有32种(不含立体异构) |
1.将金属钠投入下列物质的溶液中,有气体放出,且产生沉淀的是( )
| A. | 稀盐酸 | B. | K2SO4溶液 | C. | CuSO4溶液 | D. | NaOH溶液 |
18.下列化学用语对应正确的是( )
| A. | CH4分子的比例模型: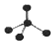 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: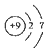 |