题目内容
7.在下列各溶液中,离子一定能大量共存的是( )| A. | 强碱性溶液中:K+、Cu2+、Cl-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Ba2+、OH-、NO3- | |
| C. | 含有0.1 mol•L-1 Ca2+酸溶液中:Na+、K+、CO32-、Cl- | |
| D. | 室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
分析 A.铜离子碱性溶液中的氢氧根离子反应;
B.铜离子与氢氧根离子反应生成氢氧化铁沉淀;
C.钙离子与碳酸根离子反应生成难溶物碳酸钙;
D.四种离子之间不反应,都不与酸性溶液中的氢离子反应.
解答 解:A.Cu2+与碱性溶液中的氢氧根离子反应生成氢氧化铜沉淀,在溶液中不能大量共存,故A错误;
B.Fe3+、OH-之间反应生成氢氧化铁沉淀,在溶液中不能大量共存,故B错误;
C.Ca2+、CO32-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
D.Na+、Fe3+、NO3-、SO42-之间不反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是( )
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
18.下列化学用语对应正确的是( )
| A. | CH4分子的比例模型: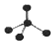 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: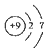 |
15.巴豆酸是一种对肠胃道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3-CH=CH-COOH.根据巴豆酸结构特点,判断下列说法正确的是( )
| A. | 巴豆酸能使溴的CCl4溶液褪色 | |
| B. | 巴豆酸不能使酸性KMnO4溶液褪色 | |
| C. | 1mol巴豆酸能与2molH2发生加成反应 | |
| D. | 巴豆酸能与CH3CH2OH发生取代反应 |
16.关于3C+SiO2 $\frac{\underline{\;高温\;}}{\;}$ SiC+2CO↑,下列说法正确的是( )
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | C 既是氧化剂又是还原剂 | |
| D. | 若生成4.48L CO,则转移0.4 mol 电子 |
17.C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2的反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
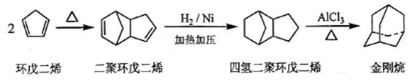
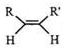 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO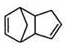 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$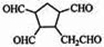 .
.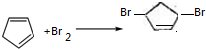 .
.