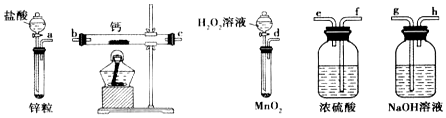
题目内容
9.A.H2SO4+2NaOH═Na2SO4+2H2O B.2Al+6HCl═2AlCl3+3H2↑C.CO2+2NaOH═Na2CO3+H2O D.Fe2O3+3CO═2Fe+3CO2
E.Fe+CuCl2═FeCl2+Cu F.2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2
G.CaCO3+2HCl═CaCl2+H2O+CO2↑ H.2KClO3$\frac{{\underline{Mn{O_2}}}}{△}$2KCl+3O2↑
(1)在上述A-H的化学反应中属于化合反应的是F,属于分解反应的是H,属于置换反应的是BE,属于复分解反应的是ACG.
(2)查阅资料获得以下信息:
a.凡是有元素化合价升降的化学反应都是氧化还原反应
b.在化学反应中反应物所含元素化合价降低的物质叫做氧化剂
c.在化学反应中反应物所含元素化合价升高的物质叫做还原剂
例如:在化学方程式 2Na+2HCl═2NaCl+H2↑中,反应前钠元素的化合价为0价,氢元素的化合价为+1价,反应后钠元素的化合价为+1价,氢元素元素的化合价为0价,所以该反应为氧化还原反应,还原剂为Na,氧化剂为HCl.
①在上述A-H的化学反应中属于氧化还原反应的是BDFH,
②在反应D中氧化剂是Fe2O3,还原剂是CO.
分析 (1)化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;
分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;
置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应是两种化合物相互交换成分生成两种新的化合物的反应,据此判断.
(2)①有元素化合价升降的化学反应是氧化还原反应;
②化合价降低的反应物为氧化剂,化合价升高的反应物为还原剂.
解答 解:(1)A.H2SO4+2NaOH═Na2SO4+2H2O是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;
B.2Al+6HCl═2AlCl3+3H2↑,一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
C.CO2+2NaOH═Na2CO3+H2O是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;
D.Fe2O3+3CO═2Fe+3CO2,不属于四种基本反应类型,但反应前后化合价发生变化,属于氧化还原反应;
E.Fe+CuCl2═FeCl2+Cu,一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
F.2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2两种物质反应后生成一种物质的反应,属于化合反应;
G.CaCO3+2HCl═CaCl2+H2O+CO2↑是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;
H.2KClO3$\frac{{\underline{Mn{O_2}}}}{△}$2KCl+3O2↑,一种物质反应后生成两种或两种物质,属于分解反应;
故答案为:F;H;BE;ACG;
(2)①有元素化合价升降的化学反应是氧化还原反应,所以A-H的化学反应中属于氧化还原反应的是BDFH,故答案为:BDFH;
②D.Fe2O3+3CO═2Fe+3CO2,Fe元素化合价降低,则Fe2O3为氧化剂,C元素化合价升高,则CO为还原剂,故答案为:Fe2O3;CO.
点评 本题主要考查了四种基本反应类型及氧化还原反应的判断,难度不大,新信息获取、处理能力,充分理解氧化还原反应的含义是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
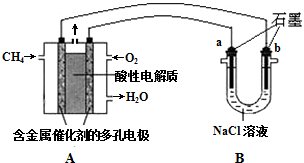
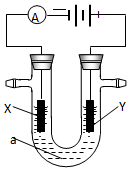 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式: