题目内容
4. A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)
A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)(1)①B、C、D第一电离能由大到小的顺序为N>O>S.
②基态E原子外围电子排布式是3d104s1.
(2)DC2分子中D原子轨道的杂化类型为sp2.与DC2互为等电子体的一种阴离子的化学式:NO2-.
(3)lmol(AB)2(直线形分子)中含有π键的数目为4×6.02×1023.
(4)C和E能形成晶胞如图所示的甲、乙两种化合物.
①甲的化学式为CuO.
②高温时甲易转化为乙的原因是Cu2O中Cu原子d轨道为全满状态,比较稳定.
分析 A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,原子核外电子排布式为1s22s22p2,故A为碳元素;D元素原子M层有一对成对的p电子,原子核外电子排布式为1s22s22p63s23p4,故D为S元素,C、D同一主族,则C为O元素;B的原子序数介于碳、氧之间,故B为N元素;元素E位于周期表ⅠB族,则E为Cu元素.
(1)①同周期随原子序数增大,元素第一电离能呈增大趋势,但ⅡA族、ⅤA族第一电离能高于同周期相邻元素的,同主族自上而下第一电离能减小;
②根据能量最低原理书写;
(2)计算SO2分子中S原子价层电子对数,确定杂化轨道数目,进而确定原子轨道的杂化类型;原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)(CN)2的结构式为N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键;
(4)①根据均摊法计算晶胞中黑色球、白色球数目,进而确定化学式;
②原子处于半满、全满、全空时,比较稳定.
解答 解:A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,原子核外电子排布式为1s22s22p2,故A为碳元素;D元素原子M层有一对成对的p电子,原子核外电子排布式为1s22s22p63s23p4,故D为S元素,C、D同一主族,则C为O元素;B的原子序数介于碳、氧之间,故B为N元素;元素E位于周期表ⅠB族,则E为Cu元素.
(1)①同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,同主族自上而下第一电离能减小,故N、O、S三种元素的第一电离能数值由大到小的顺序为N>O>S,
故答案为:N>O>S;
②元素E位于周期表ⅠB族,原子外围电子排布式是3d104s1,
故答案为:3d104s1;
(2)SO2分子中S原子价层电子对数=2+$\frac{1}{2}$×(6-2×2)=3,杂化轨道数目为3,原子轨道的杂化类型为sp2;S原子最外层6个电子可以用N原子及一个单位负电荷替换,得到与SO2互为等电子体的一种阴离子的化学式为NO2-,
故答案为:sp2;NO2-;
(3)(CN)2的结构式为N≡C-C≡N,1个(CN)2分子中含有4个π键,lmol(CN)2分子中含有π键的数目为4×6.02×1023,
故答案为:4×6.02×1023;
(4)①O、Cu能形成晶胞如图所示的两种化合物,甲中白色球数目=4,黑色球数目=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,
故答案为:CuO;
②乙中白色球数目=4,黑色球数目=1+8×$\frac{1}{8}$=2,白色球与黑色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙,
故答案为:Cu2O中Cu原子d轨道为全满状态,比较稳定.
点评 本题综合考查物质结构与性质,涉及元素推断、核外电子排布、电离能、杂化轨道、等电子体、化学键、晶胞计算等,推断元素是解题关键,(4)中从结构分析氧化铜高温转化为氧化亚铜为易错点、难点,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 碳纤维、合成纤维和光导纤维都是无机非金属材料 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝 |
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
| 物 质 | 试 剂 | 分 离 方 法 | |
| A. | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
| B. | 硬脂酸钠(甘油) | 饱和食盐水 | 盐析后过滤 |
| C. | KNO3(KCl) | 水 | 蒸发结晶 |
| D. | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| 元素编号 | 元素性质与原子(或分子)结构 |
| W | 周期表中原子半径最小的元素 |
| X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | M层比K层少1个电子 |
| T | 存在两种同素异形体,其中一种可吸收紫外线 |
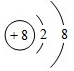 .
.(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
 .
.(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 $\frac{\underline{\;\;△\;\;}}{\;}$ 丙+丁,该反应为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式N2H4+2H2O2=N2↑+4H2O.
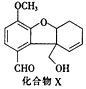
| A. | 分子中含2个手性碳原子 | |
| B. | 分子中所有碳原子均处于同一平面 | |
| C. | 能发生银镜反应,不能发生酯化反应 | |
| D. | 1molX最多能与4molH2发生加成反应 |
| A. | 18O的中子数为8 | B. | 16O和18O质子数相差2 | ||
| C. | 16O与18O核电荷数相等 | D. | 1个16O与1个18O质量相等 |
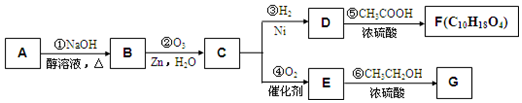
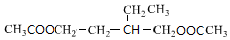 ,E
,E .
.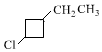 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$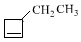 +NaBr+H2O,C→D
+NaBr+H2O,C→D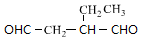 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$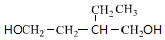 .
.