题目内容
5.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
分析 A.鸡蛋清溶于水所得澄清液体为胶体分散系;
B.丝、毛的成分为蛋白质;
C.陶瓷的主要成分为黏土;
D.酶作催化剂.
解答 解:A.鸡蛋清溶于水所得澄清液体为胶体分散系,有丁达尔现象,故A错误;
B.丝、毛的成分为蛋白质,含N元素,而棉、麻完全燃烧都只生成CO2和H2O,故B错误;
C.陶瓷的主要成分为黏土,不含SiO2,故C错误;
D.酶作催化剂,则人体内的酶通常通过降低反应的活化能来加快对应反应速率,故D正确;
故选D.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
15.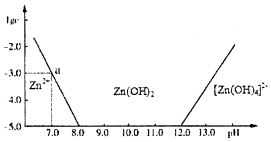 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
根据上表数据判断下列说法正确的是C D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
16.某有机物的结构简式为 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )
 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
13.某化学电源的工作原理如图.下列说法不正确的是( )
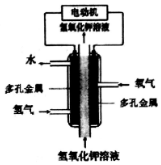

| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
20.相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.下列判断不正确的是( )
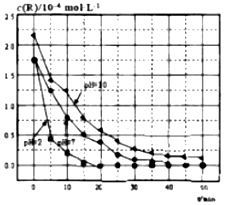

| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
10.下列过程对应的离子方程式正确的是( )
| A. | 碳酸钠溶于水中:CO32-+2H2O?H2CO3+2OH- | |
| B. | 硫酸氢铵与少量氢氧化钠溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化铝溶液中滴入过量浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 酸性高锰酸钾溶液与草酸溶液混合:5H2C2O4+6H++2MnO4-═2Mn2++10CO2↑+8H2O |
17.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| B. | 32 g Cu和32 g S充分反应,转移的电子数为0.5NA | |
| C. | 1 mol Si中含有共价键数目为4NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |

