题目内容
17.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| B. | 32 g Cu和32 g S充分反应,转移的电子数为0.5NA | |
| C. | 1 mol Si中含有共价键数目为4NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
分析 A.AlCl3溶液中Al3+发生水解反应;
B.Cu和S反应生成Cu2S;
C.每个Si与相邻的4个Si形成4条Si-Si,每条Si-Si为2个Si所共有;
D.标准状况下,甲醇不是气体.
解答 解:A.AlCl3溶液中Al3+发生水解反应,所以在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA,故A错误;
B.Cu和S反应生成Cu2S,32gCu完全反应而S剩余,转移电子数为$\frac{32g}{64g/mol}{×N}_{A}mo{l}^{-1}$×[(+1)-0]=0.5NA,故B正确;
C.每个Si与相邻的4个Si形成4条Si-Si,每条Si-Si为2个Si所共有,所以1 mol Si中含有共价键数目为2NA,故C错误;
D.标准状况下,甲醇不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算物质的量,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,涉及盐类的水解、晶体的结构、元素及其化合物的性质等知识,注意公式n=$\frac{V}{{V}_{m}}$的使用条件.

练习册系列答案
相关题目
7.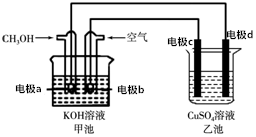 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )| A. | 甲池化学能转化为电能,工作时OH-由a→b定向移动 | |
| B. | 通电时,整个电路中电流方向为b→c,d→a | |
| C. | 乙池中CuSO4溶液的浓度不变 | |
| D. | 电极d是纯铜,此过程中电子转移0.05mol |
8.下列说法正确的是( )
| A. | 镁带燃烧可以用CO2灭火 | |
| B. | 单晶硅是重要的半导体材料,常用于制造光导纤维 | |
| C. | Cl2能使湿润的有色布条褪色,是因为Cl2的氧化性 | |
| D. | 金属钠可保存在煤油中 |
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
12.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y与W同主族.物质A、B、C均由其中三种元素组成,且为中学常见强电解质,可发生反应A+2B═C+2H2O.下列推断正确的是( )
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |
2.吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如图所示.下列说法正确的是( )


| A. | 吗替麦考酚酯的分子式为C23H30O7N | |
| B. | 吗替麦考酚酯可发生加成、取代、消去反应 | |
| C. | 吗替麦考酚酯分子中所有碳原子一定处于同一平面 | |
| D. | 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应 |
3.有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐.运用该原理生产铜和绿矾(FeSO4•7H2O)的流程如图:
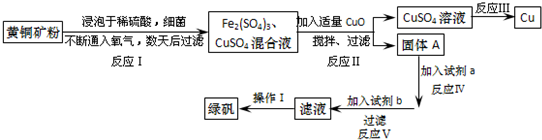
回答下列问题:
(1)已知:
加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因Fe3+在溶液中存在存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO消耗溶液中的H+,使c(H+)减小,使Fe3+转化为Fe(OH)3沉淀而除去,不损耗铜离子且不引入杂质.
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.

回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| B. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、CO32-、NO3- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
