题目内容
4.某化合物的结构(键线式)及球棍模型如下:
该有机物分子的1H核磁共振谱如下(单位是ppm).

下列关于该有机物的叙述不正确的是( )
| A. | 该有机物分子中不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 该有机物可发生水解反应 |
分析 A.该有机物结构不对称,含8种位置的H原子;
B.该有机物中不含苯环;
C.Et代表-CH2CH3;
D.含-COOC-.
解答 解:A.该有机物结构不对称,含8种位置的H原子,所以核磁共振波谱图中有8种峰,故A正确;
B.该有机物中不含苯环,则不属于芳香族化合物,故B错误;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C正确;
D.含-COOC-可发生水解反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质的关系为解答的关键,侧重酯的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.几种短周期元素的原子半径和主要化合价见表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 在化学反应中,M原子既不容易失去电子,又不容易得到电子 | |
| B. | 等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多 | |
| C. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| D. | Z的氢化物的稳定性强于L的氢化物的稳定性 |
12.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后,又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A. | CH4 | B. | C3H6 | C. | C2H6 | D. | C3H8 |
19.某粒子用${\;}_{Z}^{A}$Rn+表示,下列关于该粒子的叙述中正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=A+n | D. | 所含质子数=A+Z |
9. 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差26 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
16.下列图示与对应的叙述相符的是( )
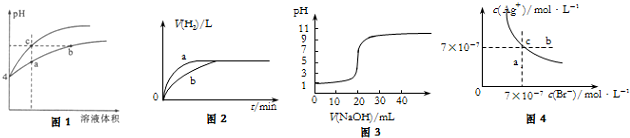

| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |
13.某无色溶液中,若加入溴水,溴水褪色,若加入NH4Cl固体加热,产生刺激性气味的气体,则该溶液中大量存在的离子可能是( )
| A. | Fe3+、Mg2+、S2-、Cl- | B. | H+、Na+、SO42-、NO3- | ||
| C. | K+、Ba2+、OH、SO32- | D. | Na+、K+、Cl-、OH- |
14.已知硼元素有两种天然同位素10B和11B,硼元素的原子量为10.80,则10B和11B的原子个数比为( )
| A. | 1:4 | B. | 1:3 | C. | 1:1 | D. | 4:1 |