题目内容
 人工光合作用能够借助太阳能,用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH原理示意图,下列说法中正确的是( )
人工光合作用能够借助太阳能,用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH原理示意图,下列说法中正确的是( )| A、催化剂a处通CO2气体,催化剂b处加水 |
| B、催化剂a处发生的反应为2H2O+4e-=O2↑+4H+ |
| C、该电池的电解质溶液可采用HCOOH溶液 |
| D、在合成HCOOH的过程中,电池内部的H+的物质的量浓度不发生改变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由图可知,左室投入是水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH.
解答:
解:A、电子由催化剂a表面流向催化剂b表面,说明催化剂a为负极,催化剂b为正极,在原电池中,负极发生氧化反应,即水在催化剂a表面发生氧化反应,二氧化碳在催化剂b表面发生还原反应,催化剂a表面的反应式为2H2O-4e-=4H++O2↑,有氧气生成,故A错误;
B、催化剂a表面的反应式为2H2O-4e-=4H++O2↑,发生氧化反应,故B错误;
C、依题意,以二氧化碳和水为原料,在太阳能作用下生成HCOOH,所以电解可以用HCOOH,增强导电性,故C正确;
D、由于生成HCOOH,电池内部的H+的物质的量浓度增大,故D错误;
故选C.
B、催化剂a表面的反应式为2H2O-4e-=4H++O2↑,发生氧化反应,故B错误;
C、依题意,以二氧化碳和水为原料,在太阳能作用下生成HCOOH,所以电解可以用HCOOH,增强导电性,故C正确;
D、由于生成HCOOH,电池内部的H+的物质的量浓度增大,故D错误;
故选C.
点评:本题考查了能量转化关系的分析应用,电解池原理的分析判断,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
少量铁粉与100ml0.01mol/L稀盐酸反应.为了加快速率而不改变H2产量,可以使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤滴加几滴硫酸铜溶液 ⑥适当升高温度(不考虑盐酸挥发) ⑦改用10ml 0.1mol/L的盐酸( )
| A、③⑤⑥⑦ | B、③⑥⑦ |
| C、③④⑤⑥⑦ | D、①③⑤⑦ |
如图有关电化学的示意图正确的是( )
A、 |
B、 |
C、 |
D、 |
下列反应中,不属于氧化还原反应的是( )
A、2 H2O2
| ||||
B、2 Al(OH)3
| ||||
C、Fe2O3+3 CO
| ||||
| D、Cl2+2 NaOH═NaCl+NaClO+H2O |
铁投入到CuSO4溶液中( )
| A、铁是氧化剂 |
| B、CuSO4是还原剂 |
| C、铁被氧化 |
| D、铁是还原剂 |
已知:①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ?mol-1,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ?mol-1.下列关于肼和NO2反应的热化学方程式中正确的是( )
| A、2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7 kJ?mol-1 | ||
| B、2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1000.3 kJ?mol-1 | ||
C、N2H4(g)+NO2(g)═
| ||
| D、2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ?mol-1 |
 (1)写出实验室用二氧化锰和浓盐酸反应制取氯气的离子方程式
(1)写出实验室用二氧化锰和浓盐酸反应制取氯气的离子方程式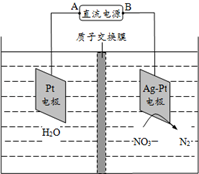 化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示:
化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示: