题目内容
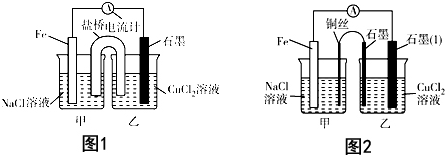
3.电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:Ⅰ.(1)如图1为某实验小组依据氧化还原反应:(用离子方程式表示)Fe+Cu2+=Cu+Fe2+设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过3mol电子.
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑,这是由于NH4Cl溶液显酸性(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因NH4++H2O?NH3•H2O+H+.
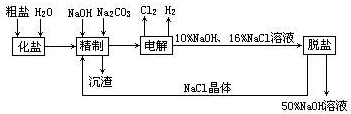
(3)如图2其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为阴极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为2Cl--2e-=Cl2↑.
Ⅱ.如图所示装置,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL.

请完成下列问题:
①第②极上生成的物质为0.005mol.
②写出第①极上发生反应的电极反应式Cu2++2e-=Cu.
③设A池中原混合液的体积为200mL,则通电前A池原混合液中Cu2+的浓度为0.025 mol/L.
分析 Ⅰ、(1)根据自发氧化还原反应知识来书写,并根据两极反应结合两极质量变化进行计算;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,正极生成氢气;
(3)根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池;
Ⅱ、通电5min后,第③极增重2.16g,则该电极是阴极,所以④是阳极,①是阴极,②是阳极,
第③极增重2.16g即生成银$\frac{2.16g}{108g/mol}$=0.02mol,电极反应:Ag++e-=Ag,转移电子的物质的量为:$\frac{2.16g}{108g/mol}$=0.02mol,
在A池中发生的反应为:阳极(②极):4OH--4e-=2H2O+O2↑,①电极反应式为:Cu2++2e-=Cu,若Cu2+完全放电后还有:2H++2e-=H2↑,当转移电子0.02mol,结合电极方程式计算.
解答 解:Ⅰ.(1)设计的原电池装置的自发氧化还原反应是:Fe+Cu2+=Cu+Fe2+,设电子转移量是x,则64×0.5x-56×0.5x=12,解得x=3,
故答案为:Fe+Cu2+=Cu+Fe2+;3;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:NH4++H2O?NH3•H2O+H+,正极发生2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;酸性;NH4++H2O?NH3•H2O+H+;
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,Cu丝是正极,所以其中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,故答案为:阴;2Cl--2e-=Cl2↑;
Ⅱ.①通电5min后,第③极增重2.16g,则该电极是阴极,所以④是阳极,①是阴极,②是阳极,
第③极增重2.16g即生成银$\frac{2.16g}{108g/mol}$=0.02mol,电极反应:Ag++e-=Ag,转移电子的物质的量为:$\frac{2.16g}{108g/mol}$=0.02mol,在A池中发生的反应为:阳极(②极):4OH--4e-=2H2O+O2↑,当转移电子0.02mol,则会生成氧气0.005mol,故答案为:0.005;
②因①是阴极,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③阴极(①极):Cu2++2e-=Cu,若Cu2+完全放电后还有:2H++2e-=H2↑,当转移电子0.02mol,A池会生成氧气0.005mol,在A池中收集到标准状况下的气体224mL,即0.01mol,所以产生氢气0.005mol,此时转移电子是0.01mol,①极上析出Cu和放出H2共获得0.02mol电子,所以Cu2++2e-=Cu中转移电子是0.01mol,Cu2+的物质的量为:0.005mol,浓度是:$\frac{0.005mol}{0.2L}$=0.025mol/L,故答案为:0.025.
点评 本题涉及原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,属于综合知识的考查,难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 标准状况下,11.2L苯中含有C-H键的数目为3NA | |
| B. | 常温下,1.0LPH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA |
| A. | pH=7 | B. | pH≥7 | C. | pH≤7 | D. | C(H+)•C(OH-)=10-14 |
| A. | c(Mg2+)>c(Mn2+) | |
| B. | c(Mg2+)=c(Mn2+) | |
| C. | c(Mg2+)<c(Mn2+) | |
| D. | 沉淀类型不同,无法用Ksp比较二种离子的浓度 |
 .
. .
.