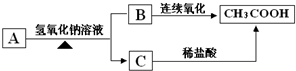
题目内容
15.Mg(OH)2和MnCO3的Ksp数值相近,在Mg(OH)2和MnCO3两份饱和溶液中( )| A. | c(Mg2+)>c(Mn2+) | |
| B. | c(Mg2+)=c(Mn2+) | |
| C. | c(Mg2+)<c(Mn2+) | |
| D. | 沉淀类型不同,无法用Ksp比较二种离子的浓度 |
分析 根据Mg(OH)2和MnCO3的Ksp的表达式分析.
解答 解:Mg(OH)2的饱和溶液中2(Mg2+)=c(OH-),则Ksp=c(Mg2+)×c2(OH-)=4c3(Mg2+),
MnCO3的饱和溶液中c(Mn2+)=c(CO32-),则Ksp=c(Mn2+)×c(CO32-)=c2(Mn2+),已知Mg(OH)2和MnCO3的Ksp数值相近,
所以c(Mg2+)<c(Mn2+),故C正确;
故选C.
点评 本题考查了溶度积常数的应用,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握饱和溶液中离子浓度的关系以及Ksp的计算公式.

练习册系列答案
相关题目
5.能说明Cl的非金属性比S强的事实有( )
①常温下S为固体,而Cl2为气体
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度
③与Fe反应,Cl2生成FeCl3,而S生成FeS
④盐酸是强酸,而氢硫酸是弱酸
⑤将Cl2通入氢硫酸中可置换出S.
①常温下S为固体,而Cl2为气体
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度
③与Fe反应,Cl2生成FeCl3,而S生成FeS
④盐酸是强酸,而氢硫酸是弱酸
⑤将Cl2通入氢硫酸中可置换出S.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
6.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl- 2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是排除空气中二氧化碳对实验的干扰;
(2)反应结束后,缓缓通入空气的目的是使生成的气体全部进入装置⑤;
(3)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
探究二:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(4)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH-(用离子方程式表示)
(5)下列选项错误的是AD
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
(6)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(7)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、
“<”或“=”)
探究一:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl- 2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是排除空气中二氧化碳对实验的干扰;
(2)反应结束后,缓缓通入空气的目的是使生成的气体全部进入装置⑤;
(3)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
探究二:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(5)下列选项错误的是AD
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
(6)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(7)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、
“<”或“=”)
10.下列关于工业生产过程的叙述正确的是( )
| A. | 联合制碱法中循环使用CO2和NH3,以提高原料利用率 | |
| B. | 硫酸工业中,SO2氧化为SO3时采用常压,因为高压会降低SO2转化率 | |
| C. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| D. | 炼钢是在高温下利用氧化剂把生铁中过多的碳和其他杂质氧化成气体或炉渣除去 |
20.5.6g Si放入100mL 3mol/L NaOH溶液中充分反应,生成气体的体积(标况)是( )
| A. | 8.96L | B. | 4.48L | C. | 6.72L | D. | .3.36L |
7.下列关于钠及其化合物的叙述不正确的是( )
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |
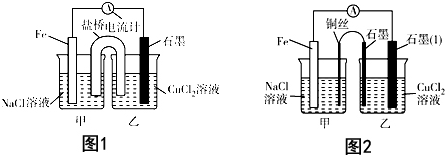

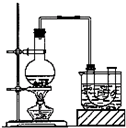 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.