题目内容
10.某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )| A. | H2XO3 | B. | HXO3 | C. | HXO4 | D. | H2X |
分析 X的气态氢化物的化学式为XH3,可知X的最低价为-3价,则最高价为+5价,以此来解答.
解答 解:X的气态氢化物的化学式为XH3,可知X的最低价为-3价,则最高价为+5价,X的最高价氧化物的水化物的化学式为HXO3,
故选B.
点评 本题考查元素的性质,为高频考点,把握元素的化合价与氢化物、最高价含氧酸的关系为解答的关键,侧重分析与应用能力的考查,注意最低价的绝对值与最高正价之和为8,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
1.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A. | 2NO2?N2O4 (正反应为放热反应) | |
| B. | C(s)+CO2?2CO (正反应为吸热反应) | |
| C. | N2+3H2?2NH3 (正反应为放热反应) | |
| D. | H2S?H2+S(s) (正反应为吸热反应) |
18.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
5.在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是( )
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |
15.室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
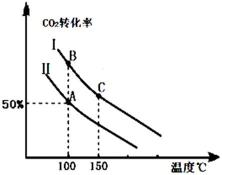 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.