题目内容
18.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
分析 A.硫蒸气变化为硫固体为放热过程;
B.物质具有的能量越多越不稳定;
C.2g即1mol氢气燃烧放热285.8KJ,则2mol氢气燃烧放热为571.6kJ;
D.浓H2SO4与氢氧化钠反应放出的热量除了中和热之外还有浓硫酸溶于水放出的热量.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B.由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知,金刚石具有的能量多,则石墨比金刚石稳定,故B错误;
C.在101 kPa时,2g即1mol氢气燃烧放热285.8KJ,则2mol氢气燃烧放热为571.6kJ,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,故C错误;
D.在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,由于浓硫酸溶解放热,所以放出的热大于57.3 kJ,故D正确.
故选D.
点评 本题考查了物质稳定性与能量的关系、燃烧热和中和热的概念、热化学方程式的意义等知识,属于综合知识的考查,题目难度不大,注意把握中和热的概念以及反应热的计算方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
6.在一定温度下将CO和水蒸气各1mol放在密闭容器中反应:CO+H2O?CO2+H2,达平衡后测得CO2为0.6mol.再通入4mol水蒸气,达到新的平衡后,CO2的物质的量为( )
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
3.向CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$一定减小的是( )
①NaOH固体②NaHSO4固体 ③氯化钠水溶液④CH3COONa固体 ⑤冰醋酸⑥降低温度.
①NaOH固体②NaHSO4固体 ③氯化钠水溶液④CH3COONa固体 ⑤冰醋酸⑥降低温度.
| A. | ①③④ | B. | ②③⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
10.某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | HXO4 | D. | H2X |
7.化学与科学、技术、社会、环境都密切相关,下列说法不正确的是( )
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |

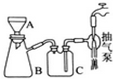 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: