题目内容
20.“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.(1)下列措施中,不利于降低大气中CO2浓度的有c(填字母).
a.减少化石燃料的使用
b.植物造林,增大植被面积
c.用家用汽车代替公交车
d.利用太阳能、风能、潮汐能
e.采用节能技术,尽可能地降低含碳燃料的用量
(2)将CO2转化为有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
b.CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,原子利用率最高的是c.(填字母)
(3)该题“第(2)问”中的一种有机物能与Na2CO3溶液反应放出CO2该有机物所含的官能团是羧基(写名称),写出该有机物与Na2CO3,溶液反应放出CO2的化学方程式2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑.
(4)为了控制温室效应,各国科学家提出了不少方法和设想.有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中CO2的浓度.为使CO2液化,可采取的措施是d(填字母).
a.减压、升温b.增压、升温c.减压、降温d.增压、降温.
分析 (1)根据自然界中二氧化碳的主要来源,以及可以吸收二氧化碳的方法回答;
(2)根据自然界中碳、氧循环的途径回答,自然界中碳氧循环主要涉及光合作用和呼吸作用,最合理的是自然循环过程.原子利用率最高的是应是化合反应,所有原子都可进入产品;
(3)该题“第(2)问”中CH3COOH能与Na2CO3溶液反应放出CO2,醋酸的官能团是羧基;
(4)根据液态CO2密度大于海水密度及减小大气中CO2的浓度可使气态CO2变为液态来分析解答采取的措施.
解答 解:(1)a.减少化石燃料的使用,可以减少向大气中排放二氧化碳,故a正确;
b.植树造林,增大植被面积,可以通过光合作用吸收部分二氧化碳,故b正确;
c.用家用汽车代替公交车,加大了汽车尾气的排放,故c错误;
d.采用节能技术,可减少化石燃料的利用,也能减少二氧化碳的排放,故d正确;
e.采用节能技术,可减少化石燃料的利用,也能减少二氧化碳的排放,故e正确;
故答案为:c;
(2)光合作用是自然界中碳循环的反应,不需要再人为提供能源,所以最好,c是化合反应,所有原子都变成了产物,所以利用率最高,
故答案为:a;c;
(3)该题“第(2)问”中CH3COOH能与Na2CO3溶液反应放出CO2,醋酸的官能团是羧基,化学方程式为2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑,
故答案为:羧基;2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑;
(4)由物质的三态变化可知,在大气条件下,二氧化碳是无色无味的气体,而在温度低于31.2℃时,加压可使CO2变为液态,即加压降温可减小分子之间的间隔,使二氧化碳由气体变为液体,则可将CO2液化后送入深海海底,以减小大气中CO2的浓度,
故答案为:d.
点评 本题考查了常见的生活环境的污染和治理措施,题目难度不大,把握环境污染的原因和治理措施是解题的关键,试题有利于培养学生的分析、理解能力及对化学知识的应用能力.

| A. | 元素电负性越大的原子,吸引电子的能力越强 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | NF3较NH3难于与Cu2+形成配位键 |
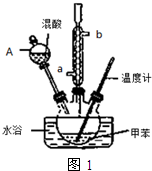 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.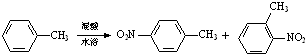
实验中可能用到的数据:
| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
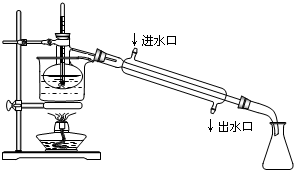
②在三颈瓶中加入13g甲苯(易挥发),按图1所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
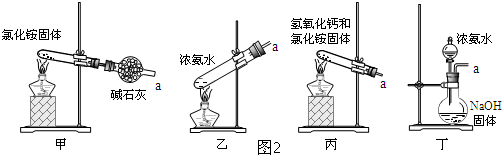
(4)分离反应后产物的方案如图2:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)该实验中一硝基甲苯的产率为77.5%(保留三位有效数字).
| A. | H2XO3 | B. | HXO3 | C. | HXO4 | D. | H2X |

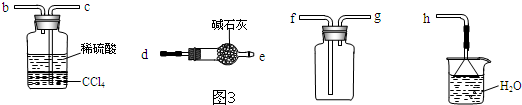



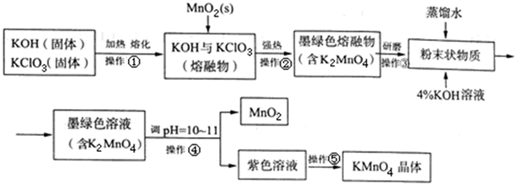
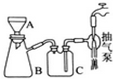 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: