题目内容
1.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )| A. | 2NO2?N2O4 (正反应为放热反应) | |
| B. | C(s)+CO2?2CO (正反应为吸热反应) | |
| C. | N2+3H2?2NH3 (正反应为放热反应) | |
| D. | H2S?H2+S(s) (正反应为吸热反应) |
分析 加压或降温都能使化学平衡向逆反应方向移动,则反应为气体体积增大、吸热的反应,以此来解答.
解答 解:A.加压或降温都能使化学平衡向正反应方向移动,故A不选;
B.该反应为气体体积增大、吸热的反应,加压或降温都能使化学平衡向逆反应方向移动,故B选;
C.加压或降温都能使化学平衡向正反应方向移动,故C不选;
D.加压平衡不移动,降温能使化学平衡向逆反应方向移动,故D不选;
故选B.
点评 本题考查化学平衡的移动,为高频考点,把我温度、压强对化学平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
相关题目
16.硼酸(H3BO3)为白色粉末状结晶,大量用于玻璃工业,可以改善玻璃制品的耐热、透明性能,提高机械强度,缩短熔融时间.以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、Al2O3和SiO2等)为原料制备硼酸的工艺流程如下(部分操作和条件略):
Ⅰ.向铁硼矿粉中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量双氧水,再调节溶液的pH约为5;
Ⅲ.过滤,将所得滤液蒸发浓缩、冷却结晶、过滤得粗硼酸和含镁盐的母液;
Ⅳ.粗硼酸精制得硼酸.
已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.01mol•L-1
请回答:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4.
(2)为提高步骤I中的反应速率,可采取的措施有升高温度、适当增大硫酸的浓度或减小铁硼矿粉的粒径等(写出两条).
(3)步骤Ⅱ的目的是将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物沉淀而除去.
(4)“粗硼酸”中的主要杂质是MgSO4.
Ⅰ.向铁硼矿粉中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量双氧水,再调节溶液的pH约为5;
Ⅲ.过滤,将所得滤液蒸发浓缩、冷却结晶、过滤得粗硼酸和含镁盐的母液;
Ⅳ.粗硼酸精制得硼酸.
已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
请回答:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4.
(2)为提高步骤I中的反应速率,可采取的措施有升高温度、适当增大硫酸的浓度或减小铁硼矿粉的粒径等(写出两条).
(3)步骤Ⅱ的目的是将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物沉淀而除去.
(4)“粗硼酸”中的主要杂质是MgSO4.
6.在一定温度下将CO和水蒸气各1mol放在密闭容器中反应:CO+H2O?CO2+H2,达平衡后测得CO2为0.6mol.再通入4mol水蒸气,达到新的平衡后,CO2的物质的量为( )
| A. | 0.6 mol | B. | 1 mol | ||
| C. | >1 mol | D. | 0.6 mol<n(CO2)<1 mol |
10.某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | HXO4 | D. | H2X |
11.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g);△H<0的平衡常数为K,下列说法正确的是( )
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |


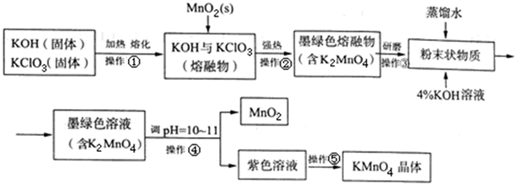
 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: