题目内容
下列溶液一定呈中性的是( )
A、c(OH-)=
| ||
| B、pH=7 的溶液 | ||
| C、c(H+)=10-14的溶液 | ||
| D、加甲基橙呈黄色的溶液 |
考点:探究溶液的酸碱性
专题:
分析:溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,当溶液中氢离子浓度大于氢氧根离子浓度时,溶液呈酸性;当氢离子浓度和氢氧根离子浓度相等时,溶液呈中性;当溶液中氢氧根离子浓度大于氢离子浓度时,溶液呈碱性,注意不能根据溶液的PH值大小判断.
解答:
解:A、根据Kw=c(H+)?c(OH-),c(OH-)=
的溶液则c(OH-)=c(H+),溶液一定呈中性,故A正确;
B、pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当PH=6时溶液呈中性,当PH=7时溶液呈碱性,故B错误;
C、c(H+)=10-14的溶液,pH=14,溶液是强碱性溶液,故C错误;
D、甲基橙显色范围:3.1-4.4,加甲基橙呈黄色,溶液的pH只要大于4.4即可,不一定是中性溶液,故D错误;
故选A.
| Kw |
B、pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当PH=6时溶液呈中性,当PH=7时溶液呈碱性,故B错误;
C、c(H+)=10-14的溶液,pH=14,溶液是强碱性溶液,故C错误;
D、甲基橙显色范围:3.1-4.4,加甲基橙呈黄色,溶液的pH只要大于4.4即可,不一定是中性溶液,故D错误;
故选A.
点评:本题考查了溶液酸碱性的判断,溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
如图为正丁腈的结构简式,正丁腈为易燃液体,有毒性,下列有关说法正确的是( )


| A、同等条件下,正丁腈在水中的溶解度比在乙醚中的溶解度大 |
| B、其分子式为C4H7N,其密度比水大 |
| C、它还可被命名为氰代丙烷,正丙基氰等,其结构中不含氢键 |
| D、正丁腈由丁烯与氨氧化而得,或由丁醇与氨催化氧化而得 |
下列实验操作不正确的是( )
A、 定容 |
B、 比较硫、碳、硅三种元素的非金属性强弱元素的非金属性强弱 |
C、 处理尾气 |
D、 测定黄铜(Cu、Zn合金)中Zn的含量 |
 推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”.人们将自来水送检,却是合格的,下列有关说法,合理的是( )
推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”.人们将自来水送检,却是合格的,下列有关说法,合理的是( )| A、商人电解自来水时,用石墨做阳极;电解净化水时,用铁做阳极 |
| B、电解自来水时,阴极反应式:O2+2H2O+4e-═4OH- |
| C、电解净化水时,a、b两极的pH变化如图2所示 |
| D、电解自来水实验中,若阴极产生气体为3.36L(标况),则阳极质量减小5.6克 |
下列关于糖的说法不正确的是( )
| A、糖类是含有醛基或羰基的有机物物质 |
| B、淀粉和纤维素都是天然高分子化合物 |
| C、葡萄糖的分子式是C6H12O6,它是一种多羟基醛 |
| D、蔗糖和麦芽糖都是二糖,它们互为同分异构体 |
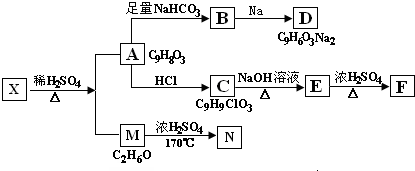
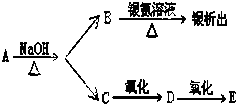 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.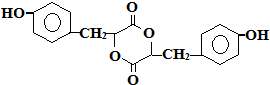 .
.