题目内容
现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体).已知C的原子序数等于A、B的原子序数之和;D的原子序数等于A、C的原子序数之和.人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素.F是一种生活中常用的金属.根据以上信息,回答下列问题:
(1)写出元素B在周期表中的位置 .
(2)写出F的单质与E的最高价氧化物对应水化物反应的化学方程式 .
(3)比较C、D气态氢化物的稳定性 > (填化学式);比较D、E、F原子半径的大小 > > (填元素符号).
(4)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,请写出该反应的离子方程式 .
(5)由A、B、D三种元素按照原子个数比 6:2:1 组成的化合物甲可与D单质构成燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入化合物甲和D单质,写出该电池的负极反应式: .
若以该燃烧电池电解足量KCl溶液,电解的化学方程式
当理论上消耗112mL(标准状况)D 气体单质时,溶液的体积为200mL,则此时溶液的PH= .
(6)由A、C、D、F四种元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X 溶液与Y溶液反应的离子方程式为 ,N→F的单质的化学方程式为 .
常温下,为使0.1mol/L M溶液中由 M 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 .
(1)写出元素B在周期表中的位置
(2)写出F的单质与E的最高价氧化物对应水化物反应的化学方程式
(3)比较C、D气态氢化物的稳定性
(4)在A、B、D三种元素中选择两种或三种元素组成两种可以发生反应的阴离子,请写出该反应的离子方程式
(5)由A、B、D三种元素按照原子个数比 6:2:1 组成的化合物甲可与D单质构成燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入化合物甲和D单质,写出该电池的负极反应式:
若以该燃烧电池电解足量KCl溶液,电解的化学方程式
当理论上消耗112mL(标准状况)D 气体单质时,溶液的体积为200mL,则此时溶液的PH=
(6)由A、C、D、F四种元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X 溶液与Y溶液反应的离子方程式为
常温下,为使0.1mol/L M溶液中由 M 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
考点:无机物的推断,位置结构性质的相互关系应用
专题:推断题,元素周期律与元素周期表专题
分析:E是短周期元素中原子半径最大的元素,E应为Na元素;
人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素,应为有机物,含有C、H元素,A与Na同一主族,则A为H元素、B为C元素;
C的原子序数等于A、B的原子序数之和,则C的原子序数为:6+1=7,则C为N元素;
D的原子序数等于A、C的原子序数之和,D的原子序数为:1+7=8,则D为O元素;
F是一种生活中常用的金属,其原子序数大于11,则F应为Al,结合对应单质、化合物的性质可解答该题.
人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素,应为有机物,含有C、H元素,A与Na同一主族,则A为H元素、B为C元素;
C的原子序数等于A、B的原子序数之和,则C的原子序数为:6+1=7,则C为N元素;
D的原子序数等于A、C的原子序数之和,D的原子序数为:1+7=8,则D为O元素;
F是一种生活中常用的金属,其原子序数大于11,则F应为Al,结合对应单质、化合物的性质可解答该题.
解答:
解:E是短周期元素中原子半径最大的元素,E应为Na元素;人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素,应为有机物,含有C、H元素,A与Na同一主族,则A为H元素、B为C元素;C的原子序数等于A、B的原子序数之和,则C的原子序数为:6+1=7,则C为N元素;D的原子序数等于A、C的原子序数之和,D的原子序数为:1+7=8,则D为O元素;F是一种生活中常用的金属,其原子序数大于11小于17,则F应为Al,
(1)B为C元素,原子序数为6,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期,ⅣA族,
故答案为:第二周期ⅣA族;
(2)F为Al,E的最高价氧化物对应水化物为NaOH,二者反应生成 偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)非金属性越强,对应的气态氢化物越稳定,非金属性:O>N,则氢化物的稳定H2O>NH3;
同周期元素从左到右原子半径逐渐减小,则Na>Al,原子核外电子层数越多,半径越大,则有Na>Al>O,
故答案为:H2O;NH3;Na;Al;O;
(4)A、B、D分别为H、C、O,由两种或三种元素组成两种可以反应的阴离子,则对应的阴离子分别为HCO3-、OH-,二者反应的离子方程式为:HCO3-+OH-=H2O+CO32-,
故答案为:HCO3-+OH-=H2O+CO32-;
(5)A、B、D分别为H、C、O,由A、B、D三种元素按照原子个数比6:2:1,其实验式为C2H6O,由于H原子已经达到饱和,则该物质的分子式即为其实验式,该燃料电池为乙醇燃料电池,电解质为氢氧化钾溶液,则负极乙醇失去电子生成碳酸根离子和水,负极电极反应为:C2H6O+16OH--12e-=2CO32-+11H2O;
电解氯化钾溶液生成氢氧化钾、氯气和氢气,电解方程式为:2KCl+3H2O
2KOH+H2↑+Cl2↑;
当理论上消耗112mL(标准状况)氧气时,氧气的物质的量为:
=0.005mol,转移的电子的物质的量为:0.05mol×4=0.02mol,根据电子守恒生成氢气的物质的量为:
=0.01mol,根据反应2KCl+3H2O
2KOH+H2↑+Cl2↑可知,生成氢氧化钾的物质的量为0.02mol,氢氧化钾溶液的浓度为:
=0.1mol/L,则此时溶液的pH=13,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O;2KCl+3H2O
2KOH+H2↑+Cl2↑;13;
(6)A、C、D、F分别为H、N、O、Al元素,F单质为金属铝,则N为氧化铝,通过电解氧化铝获得金属铝,加热Z获得氧化铝,则Z为氢氧化铝;
M为仅含非金属元素的盐,则M为硝酸铵,X、Y的溶液反应生成氢氧化铝沉淀和硝酸铵,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
N→F的反应为电解熔融氧化铝,反应的化学方程式为:2Al2O3(熔融)
4Al+3O2↑;
常温下,为使0.1mol/L硝酸铵溶液中由硝酸铵电离的阴、阳离子浓度相等,根据电荷守恒可知,溶液中c(H+)=c(OH-),溶液显示中性,则应向溶液中加入一定量的氨水至溶液的pH=7,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
4Al+3O2↑;7.
(1)B为C元素,原子序数为6,原子核外有2个电子层,最外层电子数为4,则位于周期表第二周期,ⅣA族,
故答案为:第二周期ⅣA族;
(2)F为Al,E的最高价氧化物对应水化物为NaOH,二者反应生成 偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)非金属性越强,对应的气态氢化物越稳定,非金属性:O>N,则氢化物的稳定H2O>NH3;
同周期元素从左到右原子半径逐渐减小,则Na>Al,原子核外电子层数越多,半径越大,则有Na>Al>O,
故答案为:H2O;NH3;Na;Al;O;
(4)A、B、D分别为H、C、O,由两种或三种元素组成两种可以反应的阴离子,则对应的阴离子分别为HCO3-、OH-,二者反应的离子方程式为:HCO3-+OH-=H2O+CO32-,
故答案为:HCO3-+OH-=H2O+CO32-;
(5)A、B、D分别为H、C、O,由A、B、D三种元素按照原子个数比6:2:1,其实验式为C2H6O,由于H原子已经达到饱和,则该物质的分子式即为其实验式,该燃料电池为乙醇燃料电池,电解质为氢氧化钾溶液,则负极乙醇失去电子生成碳酸根离子和水,负极电极反应为:C2H6O+16OH--12e-=2CO32-+11H2O;
电解氯化钾溶液生成氢氧化钾、氯气和氢气,电解方程式为:2KCl+3H2O
| ||
当理论上消耗112mL(标准状况)氧气时,氧气的物质的量为:
| 0.112L |
| 22.4L/mol |
| 0.02mol |
| 2 |
| ||
| 0.02mol |
| 0.2L |
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O;2KCl+3H2O
| ||
(6)A、C、D、F分别为H、N、O、Al元素,F单质为金属铝,则N为氧化铝,通过电解氧化铝获得金属铝,加热Z获得氧化铝,则Z为氢氧化铝;
M为仅含非金属元素的盐,则M为硝酸铵,X、Y的溶液反应生成氢氧化铝沉淀和硝酸铵,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
N→F的反应为电解熔融氧化铝,反应的化学方程式为:2Al2O3(熔融)
| ||
常温下,为使0.1mol/L硝酸铵溶液中由硝酸铵电离的阴、阳离子浓度相等,根据电荷守恒可知,溶液中c(H+)=c(OH-),溶液显示中性,则应向溶液中加入一定量的氨水至溶液的pH=7,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al2O3(熔融)
| ||
点评:本题考查原子结构与元素周期律知识,题目难度中等,本题考查较为综合,解答该题的关键是正确推断元素的种类,注意把握好原电池原理、电解原理,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液一定呈中性的是( )
A、c(OH-)=
| ||
| B、pH=7 的溶液 | ||
| C、c(H+)=10-14的溶液 | ||
| D、加甲基橙呈黄色的溶液 |
下列图示所表示的实验设计正确的是( )
A、 分离苯和甲苯 |
B、 制备乙烯 |
C、 测定中和热 |
D、 加入碳酸氢钠 |

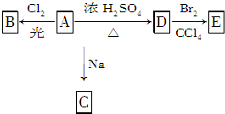 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:


 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答: