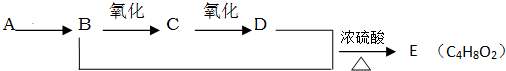
题目内容
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如图所示.

(1)写出“酸浸”过程中主要反应的离子方程式(任写一个): .
(2)物质X的化学式为 .“碱溶”时反应的离子方程式为 .
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过
程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3?6H2O晶体.结合化学平衡移动原理解释析出晶体的原因: .

(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
(2)物质X的化学式为
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过
程是
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3?6H2O晶体.结合化学平衡移动原理解释析出晶体的原因:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为
氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁;
(2)根据碳酸钙和溶液中的氢离子反应生成二氧化碳;氢氧化铝和氢氧化钠能反应生成偏铝酸钠;
(3)条件溶液的pH除去氢氧化铁;
(4)氯化氢抑制氯化铝溶解.
氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁;
(2)根据碳酸钙和溶液中的氢离子反应生成二氧化碳;氢氧化铝和氢氧化钠能反应生成偏铝酸钠;
(3)条件溶液的pH除去氢氧化铁;
(4)氯化氢抑制氯化铝溶解.
解答:
解:含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)氧化铝和氧化铁都能和盐酸反应生成盐和水,反应方程式分别是:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O或Fe2O3+6H+═2Fe3++3H2O;
(2)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,氢氧化铝和氢氧化钠溶液反应生成可溶性偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:CO2;Al(OH)3+OH-=AlO2-+2H2O;
(3)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后;
(4)氯化铝在溶液中存在溶解平衡,AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
(1)氧化铝和氧化铁都能和盐酸反应生成盐和水,反应方程式分别是:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O或Fe2O3+6H+═2Fe3++3H2O;
(2)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,氢氧化铝和氢氧化钠溶液反应生成可溶性偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:CO2;Al(OH)3+OH-=AlO2-+2H2O;
(3)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后;
(4)氯化铝在溶液中存在溶解平衡,AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
点评:本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列对物质的分类不正确的是( )
| A、H2SO4-酸 |
| B、NaOH-碱 |
| C、HClO-氧化物 |
| D、KI-盐 |
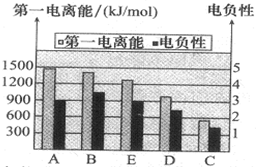 A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示: