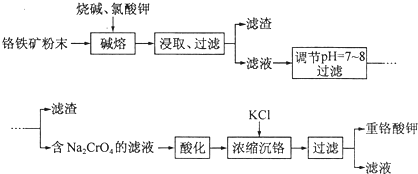
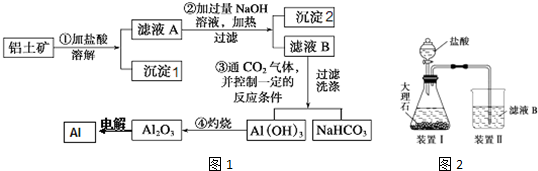
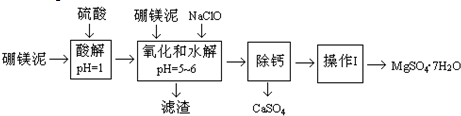
题目内容
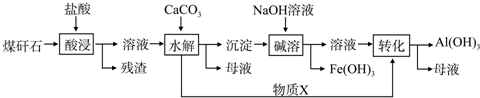
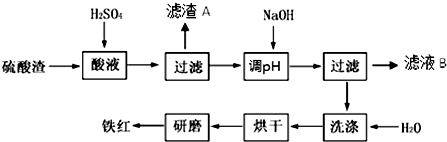
如图是提纯大理石(主要杂质是氧化铁)的流程图:

按要求回答下列问题:
(1)操作Ⅱ中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是 .
(2)检验Fe3+已完全生成Fe(OH)3沉淀的方法是 .
(3)由滤液B得到晶体B,其主要成分是 .

按要求回答下列问题:
(1)操作Ⅱ中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是
(2)检验Fe3+已完全生成Fe(OH)3沉淀的方法是
(3)由滤液B得到晶体B,其主要成分是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,加入碳酸铵生成碳酸钙沉淀过滤得到纯净的碳酸钙;
(1)依据PH试纸的使用方法回答;
(2)检验滤液中是否含铁,如含有,铁应以Fe3+形式存在,硫氰化钾溶液和铁离子反应生成血红色物质;
(3)滤液B是碳酸铵和硝酸钙反应生成的,主要是硝酸铵;
(1)依据PH试纸的使用方法回答;
(2)检验滤液中是否含铁,如含有,铁应以Fe3+形式存在,硫氰化钾溶液和铁离子反应生成血红色物质;
(3)滤液B是碳酸铵和硝酸钙反应生成的,主要是硝酸铵;
解答:
解:(1)依据PH试纸使用方法:取一小块PH试纸放在玻璃片上,用玻璃棒蘸取少量溶液点在PH试纸中间部位,变色后和比色卡对比,读出PH;
故答案为:取一小块PH试纸放在玻璃片上,用玻璃棒蘸取少量溶液点在PH试纸中间部位,变色后和比色卡对比,读出PH;
(2)过滤后的溶液中是否含铁,如含有,铁应以Fe3+形式存在,Fe3+遇KSCN溶液变为血红色,硫氰化钾溶液作为检验Fe3+的特征试剂,反应的离子方程式Fe3++3SCN-=Fe(SCN)3,取上层清液滴加几滴KSCN溶液,若仍有不变色说明Fe3+沉淀完全,若变红色证明沉淀不完全;
故答案为:取上层清液滴加几滴KSCN溶液,若仍有不变色说明Fe3+沉淀完全,若变红色证明沉淀不完全;
(3)滤液B是碳酸铵和硝酸钙反应生成的,主要是硝酸铵,
故答案为:NH4NO3;
故答案为:取一小块PH试纸放在玻璃片上,用玻璃棒蘸取少量溶液点在PH试纸中间部位,变色后和比色卡对比,读出PH;
(2)过滤后的溶液中是否含铁,如含有,铁应以Fe3+形式存在,Fe3+遇KSCN溶液变为血红色,硫氰化钾溶液作为检验Fe3+的特征试剂,反应的离子方程式Fe3++3SCN-=Fe(SCN)3,取上层清液滴加几滴KSCN溶液,若仍有不变色说明Fe3+沉淀完全,若变红色证明沉淀不完全;
故答案为:取上层清液滴加几滴KSCN溶液,若仍有不变色说明Fe3+沉淀完全,若变红色证明沉淀不完全;
(3)滤液B是碳酸铵和硝酸钙反应生成的,主要是硝酸铵,
故答案为:NH4NO3;
点评:本题考查物质的分离、提纯和除杂等实验问题,注意实验基本操作方法,把握实验原理是解题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某种有机物在稀硫酸作用下,生成相对分子质量相同的A、B两种物质,若A与碳酸钠溶液反应,而B不能,则原有机物是( )
| A、甲酸甲酯 | B、乙酸乙酯 |
| C、乙酸甲酯 | D、乙酸丙酯 |
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,物质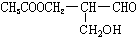 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
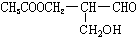 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )| A、与甲酸发生酯化反应 |
| B、与NaOH水溶液共热 |
| C、与足量的氧气作用 |
| D、在催化剂存在下与氢气作用 |
已知:3S+6KOH
2K2S+K2SO3+3H2O,在反应中被还原的硫原子与被氧化的硫原子个数比为( )
| ||
| A、1:1 | B、1:5 |
| C、1:2 | D、2:1 |