题目内容
 A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
(1)C的外围电子排布式为
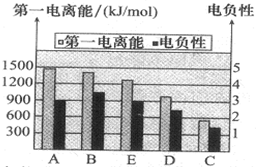
(2)如图是A、B、C、D、E的第一电离能和电负性数据,请回答:
①A的第一电离能大于B,原因是
②A、B、D三种元素的非金属性由强到弱的顺序是
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为
②该单质分子中σ键与π键的数目之比为
(4)写出C、E形成的化合物与过量的A的氢化物在水溶液中反应的离子方程式
(5)根据对角线规则,短周期中与C某些性质相似的元素F,其氧化物与NaOH溶液反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是原子序数依次增大的五种短周期元素,A单质是空气中主要成分之一,其氢化物水溶液呈碱性,则A为氮元素;C是日常生活中常见的金属,通常用电解法冶炼其单质,则C为Al元素;B原子核外有两个未成对电子,则B的外围电子排布为ns2np2或ns2np4,原子序数大于氮元素小于Al元素,处于第二周期,故B为氧元素;D元素简单阴离子带两个单位负电荷,处于ⅥA族,原子序数大于Al元素,故D为硫元素;E元素单质有毒,常温下为有色气体,常用于自来水消毒,故E为Cl元素,据此答题.
解答:
解:A、B、C、D、E是原子序数依次增大的五种短周期元素,A单质是空气中主要成分之一,其氢化物水溶液呈碱性,则A为氮元素;C是日常生活中常见的金属,通常用电解法冶炼其单质,则C为Al元素;B原子核外有两个未成对电子,则B的外围电子排布为ns2np2或ns2np4,原子序数大于氮元素小于Al元素,处于第二周期,故B为氧元素;D元素简单阴离子带两个单位负电荷,处于ⅥA族,原子序数大于Al元素,故D为硫元素;E元素单质有毒,常温下为有色气体,常用于自来水消毒,故E为Cl元素,
(1)C为铝元素,它的外围电子排布式为1s22s22p63s23p1,D的气态氢化物硫化氢,它的水溶液在空气中久置变浑浊,有硫单质生成,发生的化学反应方程式为2H2S+O2=2H2O+2S↓,
故答案为:1s22s22p63s23p1;2H2S+O2=2H2O+2S↓;
(2)①A为氮元素,B为氧元素,由于氮元素最外层p轨道上有3个电子,处于半满状态,是一种稳定结构,所以氮元素的第一电离能较大,
故答案为:氮元素最外层p轨道上有3个电子,处于半满状态,是一种稳定结构;
②电负性越大,非金属性越强,由图可知,电负性B>A>D,故非金属性B>A>D,即O>N>S,故答案为:O>N>S;
(3)①氮气分子中存在氮氮叁键,氮氮叁键的键能很大,氮气的化学性质稳定,故答案为:氮氮叁键的键能很大;
②N≡N三键中含有1个σ键、2个π键,故氮气分子中σ键与π键数目之比为1:2,故答案为:1:2;
(4)氯化铝与氨水反应生成氢氧化铝与氯化铵,反应离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(5)C为铝元素,短周期中与铝元素互为对角线位置的是铍元素,根据对角线规则,氧化铍与NaOH溶液反应的离子方程式为Be(OH)2+2OH-═BeO2-+2H2O,
故答案为:Be(OH)2+2OH-═BeO2-+2H2O.
(1)C为铝元素,它的外围电子排布式为1s22s22p63s23p1,D的气态氢化物硫化氢,它的水溶液在空气中久置变浑浊,有硫单质生成,发生的化学反应方程式为2H2S+O2=2H2O+2S↓,
故答案为:1s22s22p63s23p1;2H2S+O2=2H2O+2S↓;
(2)①A为氮元素,B为氧元素,由于氮元素最外层p轨道上有3个电子,处于半满状态,是一种稳定结构,所以氮元素的第一电离能较大,
故答案为:氮元素最外层p轨道上有3个电子,处于半满状态,是一种稳定结构;
②电负性越大,非金属性越强,由图可知,电负性B>A>D,故非金属性B>A>D,即O>N>S,故答案为:O>N>S;
(3)①氮气分子中存在氮氮叁键,氮氮叁键的键能很大,氮气的化学性质稳定,故答案为:氮氮叁键的键能很大;
②N≡N三键中含有1个σ键、2个π键,故氮气分子中σ键与π键数目之比为1:2,故答案为:1:2;
(4)氯化铝与氨水反应生成氢氧化铝与氯化铵,反应离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(5)C为铝元素,短周期中与铝元素互为对角线位置的是铍元素,根据对角线规则,氧化铍与NaOH溶液反应的离子方程式为Be(OH)2+2OH-═BeO2-+2H2O,
故答案为:Be(OH)2+2OH-═BeO2-+2H2O.
点评:本题考查结构性质位置关系、核外电子排布规律、元素周期律、化学键、铝化合物性质等,难度中等,推断元素是解题的关键,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是( )
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
某种有机物在稀硫酸作用下,生成相对分子质量相同的A、B两种物质,若A与碳酸钠溶液反应,而B不能,则原有机物是( )
| A、甲酸甲酯 | B、乙酸乙酯 |
| C、乙酸甲酯 | D、乙酸丙酯 |