题目内容
19.如图三条曲线表示C、Si和P元素的四级电离能变化趋势.下列说法正确的是( )
| A. | 电负性:c>b>a | B. | 最简单氢化物的稳定性:c>a>b | ||
| C. | I5:a>c>b | D. | 最简单氢化物的沸点:a>b>c |
分析 同主族自上而下第一电离能减小,P元素3p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故Si的第一电离能最小,由图中第一电离能可知,c为Si,P原子第四电离能为失去4s2能中1个电子,为全满稳定状态,与第三电离能相差较大,可知b为P、a为C.
A.同周期自左而右电负性增大,同主族自上而下电负性减小;
B.非金属性越强,氢化物越稳定;
C.碳、Si失去4个电子为ns2全满状态,能量更低,再失去1个电子时,第五电离能电离能与第四电离能相差较大,P失去4个电子为3s1状态,第四电离能与第五电离能均失去3s能级电子,二者能量相差不大;
D.均形成分子晶体,没有氢键存在,相对分子质量越大,分子间作用力越强,沸点越高.
解答 解:同主族自上而下第一电离能减小,P元素3p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故Si的第一电离能最小,由图中第一电离能可知,c为Si,P原子第四电离能为失去4s2能中1个电子,为全满稳定状态,与第三电离能相差较大,可知b为P、a为C.
A.同周期自左而右电负性增大,同主族自上而下电负性减小,故Si的电负性最小,故A错误;
B.Si的非金属性最弱,非金属性越强,氢化物越稳定,故SiH4的稳定性最差,故B错误;
C.碳、Si失去4个电子为ns2全满状态,能量更低,再失去1个电子时,第五电离能电离能与第四电离能相差较大,P失去4个电子为3s1状态,第四电离能与第五电离能均失去3s能级电子,二者能量相差不大,故第五电离能C>Si>P,故C正确;
D.均形成分子晶体,没有氢键存在,相对分子质量越大,分子间作用力越强,沸点越高,故SiH4的沸点最高,CH4的沸点最低,故D错误,
故选:C.
点评 本题考查电离能、电负性、元素周期律应用、沸点比较等,关键是理解掌握原子各级电离能变化趋势,失去同一能级电子时电离能相差不大,失去同一能层不同能级电子是电离能相差较大,失去不同能层电子时电离能会发生剧增,注意全满、半满稳定状态.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案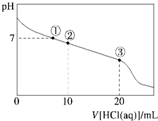 常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )
常温下,向20.00mL 0.100mol•L-1 CH3COONa溶液中逐滴加入0.100 0mol•L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( )| A. | 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)═c(CH3COOH)+c(CH3COO-) |

| A. | 光伏电池是将化学能转变为电能 | |
| B. | 光伏电池是将太阳能转变为热能 | |
| C. | 电流从b流向a | |
| D. | 图中P型半导体为负极,N型半导体为正极 |
| A. | [Co(NH3)4Cl3]Cl | B. | [Co(NH3)3Cl3] | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)5Cl]Cl3 |
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代所得产物有6种 | |
| B. | 与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 2-甲基丁烷的一氯取代物共有4种 | |
| D. | 菲的结构简式为 ,它的一硝基取代物有5种 ,它的一硝基取代物有5种 |
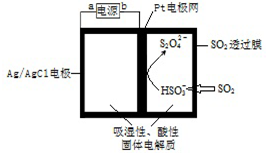
| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| A. | 氯碱工业中NaOH的溶液在阳极区产生 | |
| B. | 电解精炼铜时,阳极质量的减小等于阴极质量的增加 | |
| C. | 铁制品表面镀镍时,镀件做阳极 | |
| D. | 电解法制铝的过程中需不断补充阳极材料(石墨电极) |
| A. | 使pH试纸显深蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、HCO3-、NO3- | |
| C. | pH=1的无色溶液中:K+、Fe3+、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- |