题目内容
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B、常温下,1 L 0.1 mol?L-1 的NH4NO3溶液中氮原子数为0.2NA |
| C、1.0L的0.1 mol?L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D、用惰性电极电解饱和食盐水时,当阳极上生成11.2L气体(标况下)时,导线上转移的电子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、N2和H2的反应是一个可逆反应;
B、根据n=cV计算溶质的物质的量,结合溶质组成计算N的物质的量、个数;
C、S2-发生水解;
D、根据阳极电极反应式计算转移电子数.
B、根据n=cV计算溶质的物质的量,结合溶质组成计算N的物质的量、个数;
C、S2-发生水解;
D、根据阳极电极反应式计算转移电子数.
解答:
解:A、N2和H2的反应是一个可逆反应,l.5mol H2和0.5molN2,充分反应后可得到NH3分子数小于NA,故A错误;
B、n(NH4NO3)=1 L×0.1 mol?L-1=0.1mol,n(N)=2n(NH4NO3)=0.2mol,因此氮原子数为0.2NA,故B正确;
C、由于S2- 发生水解,Na2S溶液中含有的S2-离子数小于0.1NA,故C错误;
D、用惰性电极电解饱和食盐水时,阳极:2Cl--2e-=Cl2↑,氯气的物质的量为
=0.5mol,导线上转移的电子数的物质的量为0.5mol×2=1mol,因此导线上转移的电子数为1NA,故D错误;
故选B.
B、n(NH4NO3)=1 L×0.1 mol?L-1=0.1mol,n(N)=2n(NH4NO3)=0.2mol,因此氮原子数为0.2NA,故B正确;
C、由于S2- 发生水解,Na2S溶液中含有的S2-离子数小于0.1NA,故C错误;
D、用惰性电极电解饱和食盐水时,阳极:2Cl--2e-=Cl2↑,氯气的物质的量为
| 11.2L |
| 22.4L/mol |
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,侧重于盐类的水解反应、电解原理的应用,注意可逆反应不能进行彻底,题目较简单.

练习册系列答案
相关题目
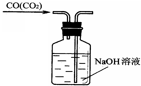
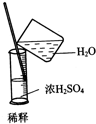
下列实验装置图正确的是( )
A、 |
B、 |
C、 |
D、 |
下列化学用语书写正确的是( )
| A、次氯酸的电离方程式:HClO?H++ClO- |
| B、铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑ |
| C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ |
| D、已知中和热为57.3 kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-57.3 kJ?mol-1 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1mol Y进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,下列说法正确的是( )
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |



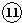 三种元素形成的气态氢化物最稳定的是
三种元素形成的气态氢化物最稳定的是