题目内容
19.pH均为5的氯化铵溶液与盐酸中,水电离出的[H+]之比为104:1,pH均为10的碳酸钠溶液与氢氧化钠溶液中,水电离出的[H+]之比为106:1.分析 盐酸溶液中的氢氧根来源于水的电离,氯化铵溶液中的氢离子来源于水的电离;碳酸钠溶液中的氢氧根离子来自水的电离,氢氧化钠溶液中的氢离子来自水的电离,据此结合溶液的pH进行计算.
解答 解:pH是5的盐酸溶液中,氢氧根来源于水的电离,由水电离出来的氢离子浓度等于由水电离出来的氢氧根离子的浓度,即c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,pH是5的氯化铵溶液,氢离子来源于水的电离,则水电离的c(H+)=10-5mol/L,
所以pH均为5的氯化铵溶液与盐酸中水电离出的[H+]之比为:10-5mol/L:10-9mol/L=104:1;
pH均为10的碳酸钠溶液中的氢氧根离子来自水的电离,则pH=10的碳酸钠溶液中水电离的氢离子浓度为:$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,
氢氧化钠溶液中的氢离子来自水的电离,则pH=10的氢氧化钠溶液中水电离的氢离子浓度为:10-10mol/L,
所以pH均为10的碳酸钠溶液与氢氧化钠溶液中,水电离出的[H+]之比为:10-4mol/L:10-10mol/L=106:1;
故答案为:104:1;106:1.
点评 本题考查了溶液盐的水解原理、溶液pH的简单计算,题目难度中等,明确酸碱溶液及能够水解的盐溶液对水的电离的影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
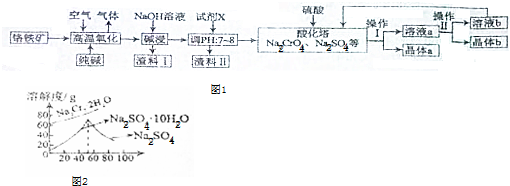
9.浓度为0.05mol•L-1的Na2SO3溶液24mL恰好能被20mL浓度为0.02mol•L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
4.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA | |
| B. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为2NA | |
| C. | T℃时,1L pH=6的某水溶液中,含1×10-8NA个OH- | |
| D. | 84g由碳酸镁和碳酸氢钠组成的混合物与足量盐酸反应生成CO2的体积为22.4L(标准状况下) |
4.加热NaHCO3和Na2CO3混合物20g,至质量不再变化为止,冷却后称量其固体质量是13.8g,则原混合物中Na2CO3的质量分数为( )
| A. | 84% | B. | 8.4% | C. | 1.6% | D. | 16% |
1.已知在常温下测得浓度均为0.1mol•L-1的下列四种溶液的pH如下表:
(1)用离子方程式表示NaClO溶液的pH=9.7的原因ClO-+H2O?HClO+OH-.
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | 11.6 | 7.5 | 9.7 |
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
2.东汉著名的炼丹理论家魏伯阳所著的《周易参同契》提出:“胡粉投火中,色坏还为铅”,已知胡粉主要成分是2PbCO3•Pb(OH)2.下列有关说法正确的是( )
| A. | 胡粉中的Pb显+4价 | |
| B. | 这里的“火”中含有炭 | |
| C. | 此过程中可能发生了化合反应 | |
| D. | 在元素周期表中铅与炭都位于第ⅥA族 |
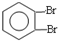 ,化合物E中所含的官能团名称为氯原子、碳碳双键.
,化合物E中所含的官能团名称为氯原子、碳碳双键.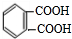 +2HOCH2CH=CH2$\stackrel{催化剂}{→}$
+2HOCH2CH=CH2$\stackrel{催化剂}{→}$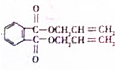 +2H2O,反应类型为酯化(取代)反应.
+2H2O,反应类型为酯化(取代)反应.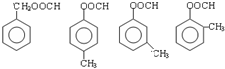 (其中一种).
(其中一种).