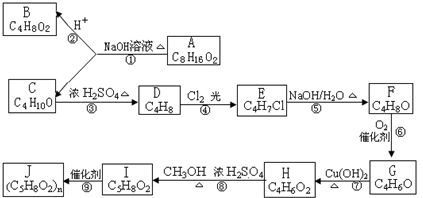
题目内容
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.电荷守恒中漏掉了氢离子浓度;
B.pH=8.3的碳酸氢钠溶液,说明碳酸氢根离子的电离程度小于其水解程度,则[CO32-]<[H2CO3];
C.氨水为弱碱,混合液中氨水过量,溶液显示碱性;
D.溶液中只存在SO42-、OH-、NH4+、H+四种离子,溶质可能为硫酸铵,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-].
B.pH=8.3的碳酸氢钠溶液,说明碳酸氢根离子的电离程度小于其水解程度,则[CO32-]<[H2CO3];
C.氨水为弱碱,混合液中氨水过量,溶液显示碱性;
D.溶液中只存在SO42-、OH-、NH4+、H+四种离子,溶质可能为硫酸铵,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-].
解答:
解:A.氯气通入氢氧化钠溶液中,根据电荷守恒可得:[Na+]+[Na+]=[Cl-]+[ClO-]+[OH-],故A错误;
B.pH=8.3的NaHCO3溶液,说明碳酸氢根离子的水解程度大于其电离程度,则:[H2CO3]>[CO32-],溶液中离子浓度大小为:[Na+]>[HCO3-]>[H2CO3]>[CO32-],故B错误;
C.pH=11的氨水与pH=3的盐酸等体积混合后,由于氨水为弱碱,则混合液中氨水过量,溶液显示碱性,则:[OH-]>[H+],根据电荷守恒可得:[NH4+]>[Cl-],溶液中离子浓度大小为:[NH4+]>[Cl-]>[OH-]>[H+],故C错误;
D.若溶液中只存在SO42-、OH-、NH4+、H+四种离子,溶质若为硫酸铵,则溶液中满足:[NH4+]>[SO42-]>[H+]>[OH-],故D正确;
故选D.
B.pH=8.3的NaHCO3溶液,说明碳酸氢根离子的水解程度大于其电离程度,则:[H2CO3]>[CO32-],溶液中离子浓度大小为:[Na+]>[HCO3-]>[H2CO3]>[CO32-],故B错误;
C.pH=11的氨水与pH=3的盐酸等体积混合后,由于氨水为弱碱,则混合液中氨水过量,溶液显示碱性,则:[OH-]>[H+],根据电荷守恒可得:[NH4+]>[Cl-],溶液中离子浓度大小为:[NH4+]>[Cl-]>[OH-]>[H+],故C错误;
D.若溶液中只存在SO42-、OH-、NH4+、H+四种离子,溶质若为硫酸铵,则溶液中满足:[NH4+]>[SO42-]>[H+]>[OH-],故D正确;
故选D.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意明确酸碱混合的定性判断方法,明确电荷守恒、物料守恒、盐的水解原理的应用,现象C为易错点,注意氨水为弱碱,混合液中氨水过量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;④0.01mol/L NaOH溶液.下列说法正确的是( )
| A、四份溶液中水的电离程度由大到小的顺序为:①=②=④<③ |
| B、若将②、③等体积混合,则混合液的pH为7 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① |
| D、若在10mL①中加入④至pH刚好等于7,则C(Na+)=C(CH3COO-),混合溶液总体积<20mL(假设混和溶液体积为酸和碱溶液体积之和) |
把200mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2,则该混合溶液中c(Na+)为( )
A、(
| ||||
| B、(2b-a) mol/L | ||||
C、(5b-
| ||||
| D、(10b-5a) mol/L |
下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,正确的组别是( )
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | NaOH溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl3溶液 | CuCl2 | Fe粉 |
| A、A | B、B | C、C | D、D |
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所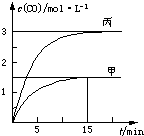 示.下列说法正确的是( )
示.下列说法正确的是( )
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所
 示.下列说法正确的是( )
示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V>0.5L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
下列描述中正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |