题目内容
写出下列反应的热化学方程式.
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4)10g 乙烷(C2H6)气体完全燃烧生成液态水放出热量520.32kJ .
(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量
(2)9g铝与足量氯气化合生成固体氯化铝,放出热量274.2kJ
(3)10g CaCO3分解吸收热量17.56kJ
(4)10g 乙烷(C2H6)气体完全燃烧生成液态水放出热量520.32kJ
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.
解答:
解:(1)4g硫粉完全燃烧生成二氧化硫气体,放出37kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出296kJ的热量,则热化学方程式为:S(s)+O2(g)═SO2(g),△H=-296kJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol;
(2)9g铝的物质的量n=
=
=
mol,与足量氯气化合生成固体氯化铝,放出热量274.2kJ,则2molAl与足量氯气化合生成固体氯化铝,放出热量274.2kJ×6=1645.2KJ,故2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1645.2kJ?mol-1,故答案为:2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1645.2kJ?mol-1;
(3)10g CaCO3的物质的量n=
=
=0.1mol,分解吸收热量17.56kJ,则1molCaCO3分解吸收热量17.56kJ×10=175.6KJ,故热化学方程式为:CaCO3(s)=CaO(s)+CO2(g)△H=+175.6kJ?mol-1,故答案为:CaCO3(s)=CaO(s)+CO2(g)△H=+175.6kJ?mol-1;
(4)10g 乙烷(C2H6)的物质的量n=
=
=
mol,完全燃烧生成液态水放出热量520.32kJ,则1molC2H6完全燃烧生成液态水放出热量520.32kJ×3=1560.96kJ,故热化学方程式为:C2H6(g)+3.5 O2(g)=2CO2(g)+3H2O(l)△H=-1560.96kJ?mol-1,故答案为:C2H6(g)+3.5 O2(g)=2CO2(g)+3H2O(l)△H=-1560.96kJ?mol-1.
故答案为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol;
(2)9g铝的物质的量n=
| m |
| M |
| 9g |
| 27g/mol |
| 1 |
| 3 |
(3)10g CaCO3的物质的量n=
| m |
| M |
| 10g |
| 100g/mol |
(4)10g 乙烷(C2H6)的物质的量n=
| m |
| M |
| 10g |
| 30g/mol |
| 1 |
| 3 |
点评:本题考查了热化学方程式的书写,难度不大,注意掌握热化学方程式的书写规则.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
相同温度下,相同物质的量浓度的七种溶液:①CH3COONa,②NaHSO4,③NaCl,④Na2CO3,⑤NaHCO3,⑥CH3COOH,⑦NH4Cl.按pH 由大到小的顺序排列正确的是( )
| A、⑤④①③⑦⑥② |
| B、②⑥⑦③①⑤④ |
| C、④⑤①③⑦⑥② |
| D、②⑥⑦③①④⑤ |
下列有关0.1mol/LKNO3溶液的叙述正确的是( )
| A、1L该溶液中含KNO3101g | ||
B、100mL该溶液中含N
| ||
| C、从1L该溶液中取出100mL,所取出的KNO3溶液的浓度为0.01mol/L | ||
| D、在1L水中溶解10.1g KNO3,即可配制得0.1mol/L KNO3溶液 |
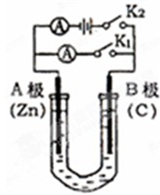 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.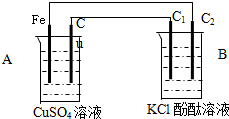 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:


