题目内容
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1 mol NaCl固体溶于1 L水所得溶液中NaCl的物质的量浓度为1 mol?L-1 |
| B、2.3 g钠转化为钠离子时失去的电子数目为0.1NA |
| C、常温常压下,11.2 L H2所含的原子数目为NA |
| D、28 g氮气所含的原子数目为NA |
考点:阿伏加德罗常数
专题:
分析:A、1 mol NaCl固体溶于1 L水所得溶液体积大于1L;
B、依据n=
计算物质的量,结合钠失电子数计算;
C、常温常压下,11.2 L H2的物质的量不是0.5mol;
D、依据n=
计算物质的量,结合氮气分子式计算;
B、依据n=
| m |
| M |
C、常温常压下,11.2 L H2的物质的量不是0.5mol;
D、依据n=
| m |
| M |
解答:
解:A、1 mol NaCl固体溶于1 L水所得溶液体积大于1L,溶液中NaCl的物质的量浓度小于1 mol?L-1,故A错误;
B、依据n=
计算物质的量=
=0.1mol,结合钠失电子数计算转化为钠离子时失去的电子数目为0.1NA,故B正确;
C、常温常压下,11.2 L H2的物质的量不是0.5mol,故C错误;
D、依据n=
计算物质的量=
=1mol,结合氮气分子式计算所含的原子数目为2NA,故D错误;
故选B.
B、依据n=
| m |
| M |
| 2.3g |
| 23g/mol |
C、常温常压下,11.2 L H2的物质的量不是0.5mol,故C错误;
D、依据n=
| m |
| M |
| 28g |
| 28g/mol |
故选B.
点评:本题考查阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,物质的量计算微粒数,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是( )
| A、Zn与稀H2SO4 |
| B、NaCl溶液与AgNO3溶液 |
| C、H2与O2 |
| D、Na2O与H2O |
将2.3g Na放入100mL浓度为0.1mol?L-1的盐酸中,充分反应后共生成标准状况下H2的体积为( )
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |
用NA表示阿伏加德罗常数,下列叙述错误的是 ( )(用字母填写)
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
下列物质的体积最大的是( )
| A、标况下,0.3 mol的NH3 |
| B、4℃时,18克水 |
| C、2mol的Al (密度为2.7g/cm3 ) |
| D、100g 37% 密度1.20 g/cm3 NaCl 溶液 |
下列反应的离子方程式正确的是( )
| A、SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO2═2Mn2++5SO42-+2H2O | ||||
| B、氯化铝溶液通入过量氨水:Al3++4OH-=AlO2-+2H2O | ||||
C、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| D、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
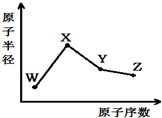 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.