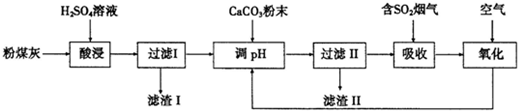
题目内容
如图是氧化沉淀法生产复印用Fe3O4粉的工艺流程图,根据要求回答问题.

(1)铁的另两种常见氧化物的化学式是 、 .
(2)副产品P是 ,由溶液N获得该副产品的操作顺序是加热浓缩→ → →晶体加热至完全失去结晶水.
(3)通空气时的化学方程式是 4Fe(OH)2+O2+2H2O═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O,控制“一定量空气”的目的是 ,沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比为 .

(1)铁的另两种常见氧化物的化学式是
(2)副产品P是
(3)通空气时的化学方程式是 4Fe(OH)2+O2+2H2O═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
| ||
考点:物质分离和提纯的方法和基本操作综合应用,物质分子中的原子个数计算
专题:实验设计题
分析:工业绿矾加水溶解过滤除去不溶性杂质得到硫酸亚铁溶液,加入适量氢氧化钠溶液同时通入一定量空气过滤得到彻底为氢氧化亚铁和氢氧化铁的混合物,加热分解生成四氧化三铁;溶液N为为硫酸钠溶液,通过蒸发浓缩冷却结晶得到硫酸钠晶体为副产品P;
(1)铁的氧化物有氧化铁、氧化亚铁、四氧化三铁;
(2)分析可知副产品为硫酸钠;溶液中得到晶体的方法是蒸发浓缩冷却结晶得到硫酸钠晶体,加热失去结晶水得到硫酸钠;
(3)通入适量空气是为了得到氢氧化亚铁和氢氧化铁的混合物,控制二者质量比,结合化学方程式计算二者最佳质量比;
(1)铁的氧化物有氧化铁、氧化亚铁、四氧化三铁;
(2)分析可知副产品为硫酸钠;溶液中得到晶体的方法是蒸发浓缩冷却结晶得到硫酸钠晶体,加热失去结晶水得到硫酸钠;
(3)通入适量空气是为了得到氢氧化亚铁和氢氧化铁的混合物,控制二者质量比,结合化学方程式计算二者最佳质量比;
解答:
解:(1)铁的氧化物有氧化铁、氧化亚铁、四氧化三铁,铁的另两种常见氧化物的化学式是FeO、Fe2O3;
故答案为:FeO、Fe2O3 ;
(2)工业绿矾加水溶解过滤除去不溶性杂质得到硫酸亚铁溶液,加入适量氢氧化钠溶液同时通入一定量空气过滤得到彻底为氢氧化亚铁和氢氧化铁的混合物,加热分解生成四氧化三铁;溶液N为为硫酸钠溶液,通过蒸发浓缩冷却结晶,过滤洗涤,得到硫酸钠晶体为副产品P;
故答案为:Na2SO4;冷却结晶;过滤;
(3)通空气时的化学方程式是 4Fe(OH)2+O2+2H2O═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O,控制“一定量空气”的目的是为了得到氢氧化亚铁和氢氧化铁的混合物,控制Fe(OH)2与Fe(OH)3的质量比,沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比符合化学方程式中物质的量之比为1:2,质量比为90:2×107=45:107;
故答案为:控制Fe(OH)2与Fe(OH)3的质量比;45:107;
故答案为:FeO、Fe2O3 ;
(2)工业绿矾加水溶解过滤除去不溶性杂质得到硫酸亚铁溶液,加入适量氢氧化钠溶液同时通入一定量空气过滤得到彻底为氢氧化亚铁和氢氧化铁的混合物,加热分解生成四氧化三铁;溶液N为为硫酸钠溶液,通过蒸发浓缩冷却结晶,过滤洗涤,得到硫酸钠晶体为副产品P;
故答案为:Na2SO4;冷却结晶;过滤;
(3)通空气时的化学方程式是 4Fe(OH)2+O2+2H2O═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3
| ||
故答案为:控制Fe(OH)2与Fe(OH)3的质量比;45:107;
点评:本题考查了物质分离和提纯方法额分析判断,主要是铁及其化合物性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1 mol NaCl固体溶于1 L水所得溶液中NaCl的物质的量浓度为1 mol?L-1 |
| B、2.3 g钠转化为钠离子时失去的电子数目为0.1NA |
| C、常温常压下,11.2 L H2所含的原子数目为NA |
| D、28 g氮气所含的原子数目为NA |
下列说法正确的是( )
| A、第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B、L层电子数为奇数的所有元素都是非金属元素 |
| C、ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
下列实验操作正确的是( )
| A、过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中 |
| B、蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解 |
| C、蒸馏时需从冷凝管上口进水,下口出水 |
| D、分液时,下层液体放完后,再从下口放出上层液体 |
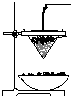 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.