题目内容
16.下列各组物质的性质比较中,正确的是( )| A. | 非金属性:P<S<Cl | B. | 氢化物稳定性:HF>H2S>H2O | ||
| C. | 碱性:Mg(OH)2>NaOH>Ca(OH)2 | D. | 原子半径:F>Cl>Br>I |
分析 A.同一周期中,原子序数越大,非金属性越强;
B.非金属性越强,对应氢化物的稳定性越强;
C.金属性越强,最高价氧化对应水合物的碱性越强;
D.同一主族元素中,原子序数越大,原子半径越大.
解答 解:A.P、S、Cl位于同一周期,原子序数逐渐增大,则非金属性逐渐增强,即非金属性金属性:P<S<Cl,故A正确;
B.非金属性F>O>S,非金属性越强,氢化物稳定性越强,则氢化物稳定性:HF>H2O>H2S,故B错误;
C.金属性Mg<Na<Ca,则最高价氧化物对应水合物的碱性:Mg(OH)2<NaOH<Ca(OH)2,故C错误;
D.F、Cl、Br、I位于同一主族,原子序数越大,原子半径越大,则原子半径大小为:F<Cl<Br<I,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,试题侧重基础知识的考查,有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
4.下列变化或现象中,与原电池反应有关的是( )
| A. | 在空气中,金属铝表面迅速氧化形成保护层 | |
| B. | 红热的铁丝与水接触,表面形成蓝黑色的保护层 | |
| C. | 常温下,浓硫酸使铝、铁等金属钝化 | |
| D. | 白铁(镀锌)表面有划伤时,仍然不易生锈 |
11.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
1.下列操作会使H2O的电离平衡向电离方向移动,且pH>7的是( )
| A. | 向水中加少量NaHSO4 | B. | 向水中加少量FeCl3 | ||
| C. | 向水中加少量Na2CO3 | D. | 将纯水加热到90℃ |
5.某学生在实验室用高锰酸钾制取氧气,错将其当做氯酸钾,向其中加入了二氧化锰,测得混合物总质量为400g,其中钾元素的质量分数为19.5%,放入试管中加热一段时间后,将所得固体加入足量水搅拌、过滤后,经实验测定得到只含一种溶质的滤液,则该同学加入的MnO2有多少克( )
| A. | 84g | B. | 32g | C. | 87g | D. | 197g |
6.某小组对Cu与浓HNO3的反应进行研究.记录如下:
I.Cu与浓HNO3反应的化学方程式是Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H20.
II.探究实验1中溶液A呈绿色而不是蓝色的原因溶液A和溶液B中,c(Cu2+) 基本相同.
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的.乙根据实验记录,认为此观点不正确,乙的依据是溶液A和溶液B中,c(Cu2+) 基本相同.
(2)乙认为溶液呈绿色是由溶解的NO2引起的.进行实验2:先将NO2通入B中,再鼓入N2.结果证实假设成立.则以上两步操作对应的现象分别是、溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出.
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色.
ii.NO2溶于水,会发生反应2NO2+H2O=HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解.
iii.NO-2能与Cu2+反应:Cu2+(蓝色)+4NO2-═Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2-4使溶液呈绿色.
丙进行如下实验:
①亚硝酸分解的化学方程式是3HNO2═HNO3+2NO↑+H2O.
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色.
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色,请依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
| 装置 | 药品 | 现象 | |
| 实验1 | 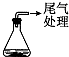 | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
II.探究实验1中溶液A呈绿色而不是蓝色的原因溶液A和溶液B中,c(Cu2+) 基本相同.
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的.乙根据实验记录,认为此观点不正确,乙的依据是溶液A和溶液B中,c(Cu2+) 基本相同.
(2)乙认为溶液呈绿色是由溶解的NO2引起的.进行实验2:先将NO2通入B中,再鼓入N2.结果证实假设成立.则以上两步操作对应的现象分别是、溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出.
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色.
ii.NO2溶于水,会发生反应2NO2+H2O=HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解.
iii.NO-2能与Cu2+反应:Cu2+(蓝色)+4NO2-═Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2-4使溶液呈绿色.
丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色.
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色,请依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
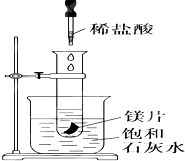 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: