题目内容
7.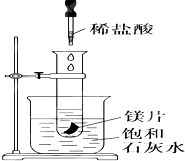 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:(1)实验中观察到的现象是镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液变浑浊.
(2)产生上述现象的原因是镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小.
(3)写出有关反应的离子方程式:Mg+2H+=Mg2++H2↑;
反应中转移了0.04mol电子时;标准状况下产生多少448mL的H2;消耗镁多少0.48g(保留两位小数);生成的MgCl2物质的量浓度为2mol/L.(溶液体积保持不变)
(4)由实验推知,镁片溶液和盐酸的总能量大于(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为放热 (填放热反应或者吸热反应).
分析 如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊;碳酸在溶液中不稳定分解生成二氧化碳气体.
解答 解:(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊,
故答案为:镁片上有大量气泡,镁片逐渐溶解,烧杯中溶液变浑浊;
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,
故答案为:镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl═MgCl2+H2↑,离子方程式为:Mg+2H+=Mg2++H2↑;
此反应中,当生成1mol氢气时转移2mol电子,故当转移0.04mol电子时,生成0.02mol电子,在标况下体积为448mL;
当转移2mol电子时,消耗1mol镁,故当转移0.04mol电子时,消耗0.02mol镁,转移为0.48g;生成的氯化镁的物质的量为0.02mol,由于体积为0.01L,故生成的氯化镁的物质的量浓度为2mol/L.
故答案为:Mg+2H+=Mg2++H2↑;448;0.48;2mol/L;
(4)此反应是放热反应,故镁片的盐酸的总能量大于MgCl2溶液和H2的总能量,故答案为:大于;放热;
点评 本题考查了化学反应现象和能量变化分析,注意分析通过化学变化放热而使饱和溶液温度升高,氢氧化钙的饱和溶液中,氢氧化钙溶解度随温度升高而减小的,掌握特征和基础是解决问题的关键.

| A. | C1:C2=3:1 | |
| B. | C2的取值范围为0 mol•L-1<C2<0.15 mol•L-1 | |
| C. | X、Y的转化率不相等 | |
| D. | C1的取值范围为0 mol•L-1<C1<0.15 mol•L-1 |

| A. | 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 | |
| B. | 用图2所示装置蒸发CuCl2溶液制得CuCl2晶体 | |
| C. | 用图3所示装置可由自来水制得蒸馏水 | |
| D. | 用图4所示装置从C2H5OH与C2H5COOCCH3的混合物中分离出乙酸乙酯 |
| A. | 117a3ρ | B. | $\frac{M}{{{N_A}{a^3}}}$ | C. | $\frac{234}{{{a^3}ρ}}$ | D. | $\frac{58.5}{{2{a^3}ρ}}$ |
| A. | 先出现沉淀而后全部溶解 | |
| B. | 当Al3+和SO42-全部沉淀所得沉淀量最大 | |
| C. | 最后只有BaSO4沉淀 | |
| D. | 最后生成0.1mol Al(OH)3和0.2molBaSO4 |
| A. | $\frac{(4b-2c)}{a}$ | B. | $\frac{(2b-c)}{a}$ | C. | $\frac{(4b-4c)}{a}$ | D. | $\frac{(2b-2c)}{a}$ |
| A. | 非金属性:P<S<Cl | B. | 氢化物稳定性:HF>H2S>H2O | ||
| C. | 碱性:Mg(OH)2>NaOH>Ca(OH)2 | D. | 原子半径:F>Cl>Br>I |
| A. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O?HCO3-+OH- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |