题目内容
1.下列操作会使H2O的电离平衡向电离方向移动,且pH>7的是( )| A. | 向水中加少量NaHSO4 | B. | 向水中加少量FeCl3 | ||
| C. | 向水中加少量Na2CO3 | D. | 将纯水加热到90℃ |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,或改变温度,据此分析.
解答 解:A、向水中加入硫酸氢钠固体,引入大量氢离子,使得氢离子浓度增大,则水的电离被抑制,且使溶液显酸性,即pH小于7,故A错误;
B、向水中加入氯化铁,由于铁离子的水解对水的电离有促进作用,故水的电离平衡右移,且氯化铁为强酸弱碱盐,水解显酸性,故使得溶液的pH小于7,故B错误;
C、向水中加入碳酸钠,由于碳酸根离子的水解对水的电离有促进作用,故水的电离平衡右移,且碳酸钠为强碱弱酸盐,水解显碱性,故使得溶液的pH大于7,故C正确;
D、纯水加热,电离被促进,溶液中的氢离子浓度变大,故pH小于7,故D错误.
故选C.
点评 本题考查了水的电离平衡影响因素的分析判断,酸碱抑制电离,水解的盐促进水的电离,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.向含有0.1mol明矾的溶液中逐滴加入含有0.2molBa(OH)2的溶液中,判断正确的是( )
| A. | 先出现沉淀而后全部溶解 | |
| B. | 当Al3+和SO42-全部沉淀所得沉淀量最大 | |
| C. | 最后只有BaSO4沉淀 | |
| D. | 最后生成0.1mol Al(OH)3和0.2molBaSO4 |
16.下列各组物质的性质比较中,正确的是( )
| A. | 非金属性:P<S<Cl | B. | 氢化物稳定性:HF>H2S>H2O | ||
| C. | 碱性:Mg(OH)2>NaOH>Ca(OH)2 | D. | 原子半径:F>Cl>Br>I |
13.晚唐诗人李商隐的《无题•相见时难别亦难》中写到“春蚕到死丝方尽,蜡炬成灰泪始干”,下列说法正确的是( )
| A. | 蜡烛的主要成分是烃,属于混合物 | |
| B. | 蚕丝属于纤维素 | |
| C. | “泪”是指石蜡燃烧生成的水 | |
| D. | 蚕丝和石蜡完全燃烧所得的产物相同 |
10.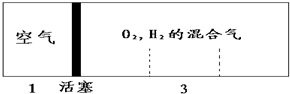 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
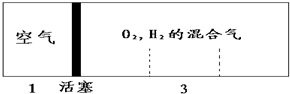 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 4:5 | C. | 5:4 | D. | 7:6 |
11.下列说法正确的是( )
| A. | 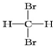 和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. | 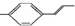 分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 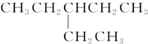 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |


 .
.