题目内容
14. 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).(1)先把混合物分离得到(C2H4O)n:将混合物放入分液漏斗中,静置,分离操作名称为分液.
(2)证明是否已有部分乙醛被氧化的实验操作和现象是取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化.
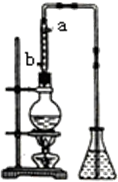
(3)提取乙醛的装置如图:烧瓶中放的是(C2H4O)n和6mol/LH2SO4的混合液,锥形瓶中是蒸馏水.加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中.
①用冷凝管的目的是使加合物冷凝回流到烧瓶内,冷凝水的进口是b(填“a”或“b”).
②锥形瓶内导管口出现气泡,从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛具有易溶于水的性质,当观察到导气管中气流很小时,必要的操作是及时撤去导管,目的是防止倒吸.
分析 (1)分离互不相溶的液体,采取分液方法进行分离;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性;
(3)①蒸馏操作时会有部分加合物随温度的升高而挥发,如果不使用冷凝管使之液化后重新流入烧瓶内,会使得到的乙醛不纯,另外原料利用率也低;应使整个冷凝管充满冷凝水,充分冷却回流;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明气体溶于溶液,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸.
解答 解:(1)久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液,先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出,
故答案为:分液漏斗;分液;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性,具体操作为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化,
故答案为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化;
(3)①利用冷凝管使挥发出的加合物液化后重新流入到烧瓶内,这样既保证了乙醛的纯度,也提高了原料的利用率,
应使整个冷凝管充满冷凝水,充分冷却回流,即冷凝水从b口通入,从a口流出,
故答案为:使加合物冷凝回流到烧瓶内;b;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛易溶于水,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,
故答案为:易溶于水;及时撤去导管;防止倒吸.
点评 本题考查混合物的分离和提纯、实验方案设计、乙醛的性质等,注意化学实验中安全意识的渗透、制备实验中原料尽可能充分利用,难度中等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(1)用如图所示装置进行实验.
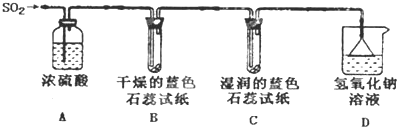
①A装置的作用是干燥二氧化硫.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是SO2+H2O=H2SO3.
③D装置的作用是吸收S02,防止污染空气,D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为硝酸,是造成酸雨的另一主要原因.
| A. | M的气态氢化物与其最高价氧化物的水化物之间能相互反应 | |
| B. | N单质能将K从其钠盐的水溶液中置换出来 | |
| C. | N的氢化物沸点高于其它同族元素氢化物的沸点 | |
| D. | P、Q、K对应的最高价氧化物的水化物相互之间可能发生反应 |
| A. | 标准状况下,22.4L庚烷的分子数约为NA | |
| B. | 1L 0.1mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA | |
| C. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| D. | 50mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
| A. | 探究Na与水的反应可能有O2生成 | |
| B. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| C. | 探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |

 A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满. .
. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.