题目内容
11. A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.(1)A的基态原子中,电子占据的最高能层符号为L,该能层的原子轨道数为5.
(2)E的基态原子的电子排布式是1s22s22p63s23p63d64s2.F+离子的价层电子排布的轨道表示式是
 .
.(3)D元素的最高价氧化物对应的水化物中,中心原子的杂化轨道类型是sp3,B元素气态氢化物的价层电子对互斥模型为四面体形.
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为
 .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.(5)某化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为CuFeS2.该晶胞上下底面为正方形,侧面与底面垂直,该晶体的密度为d g•cm-3,则阿伏加德罗常数NA=$\frac{7.36×1{0}^{32}}{da{b}^{2}}$(用含a、b、d的式子表示).
分析 A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素;C、D同主族,D的原子序数小于Fe,则D为S元素,据此解答.
解答 解:A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素;C、D同主族,D的原子序数小于Fe,则D为S元素.
(1)A为碳元素,基态原子中电子占据的最高能层为第2能层,符号L,该能层有1个s轨道、3个p轨道,共有5个原子轨道,故答案为:L;5;
(2)E的基态原子的电子排布中有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,
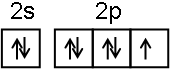
F为Cu,Cu+离子的价层电子排布3d10,其价层电子排布图是 ,
,
故答案为:1s22s22p63s23p63d64s2; ;
;
(3)D元素的最高价氧化物对应的水化物为H2SO4,中心原子的杂化轨道4+$\frac{6-2×2-1×2}{2}$=4,S原子采取sp3杂化方式;B的气态氢化物为NH3,形成3个N-H键、含有1对孤对电子,价层电子对互斥模型为 四面体形,
故答案为:sp3;四面体形;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对,SCN-的电子式为 ,SCN-的水溶液可以用于实验室中Fe3+离子的定性检验,形成配合物的颜色为血红色,
,SCN-的水溶液可以用于实验室中Fe3+离子的定性检验,形成配合物的颜色为血红色,
故答案为: ;血红色;
;血红色;
(5)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×$\frac{1}{2}$+1+8×$\frac{1}{8}$=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量=$\frac{(56+64+32×2)g/mol}{{N}_{A}mo{l}^{-1}}$×4,晶胞体积=(b×10-10 cm)2×a×10-10 cm,
该晶体的密度dg•cm-3=($\frac{(56+64+32×2)g/mol}{{N}_{A}mo{l}^{-1}}$×4)÷[(b×10-10 cm)2×a×10-10 cm],
整理可得NA=$\frac{7.36×1{0}^{32}}{da{b}^{2}}$,
故答案为:CuFeS2;$\frac{7.36×1{0}^{32}}{da{b}^{2}}$.
点评 本题是对考查物质结构的考查,涉及核外电子排布、杂化理论、价层电子对互斥理论、等电子体、晶胞计算等,需要学生具备扎实的基础,(5)为易错点、难点,难度中等.

 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO?CH3OCH3+CO2的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol.
(2)已知一些共价键的键能如下:
| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
(3)在250℃恒容密闭容器中,下列事实可以说明反应③已达平衡的是(填选项字母)BC.
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(4)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.042.
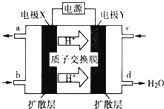
(5)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示.
①氧气应从C处通入,电极Y为正极,发生的电极反应式为O2+4e-+4H+═2H2O;
②二甲醚(CH3)2O应从b处加入,电极X上发生的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
③电池在放电过程中,电极X周围溶液的pH减小 (填“增大”“减小”或“不变”).
| A. | 朴硝和消石加强热都不分解 | |
| B. | 朴硝和消石都属于强电解质 | |
| C. | 朴硝和消石都既含有离子键又含有共价键 | |
| D. | “紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色 |
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去乙酸乙酯中少量乙醇 | 将混合物中加水,多次水洗分液 | 分液漏斗、烧杯 |
| B | 证明HClO和醋酸的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 由FeCl3溶液得到FeCl3•6H2O晶体 | 向FeCl3溶液中不断滴加盐酸,加热,至有晶体 出现 | 酒精灯、表面皿、玻璃棒 |
| D | 配制1L 0.1mol•L-1的CuSO4溶液 | 将16gCuSO4•5H2O溶于水配成1000mL溶液 | 烧杯、量筒、玻璃棒、1000mL容量瓶 |
| A. | A | B. | B | C. | C | D. | D |
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
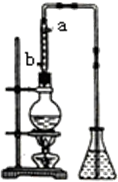
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
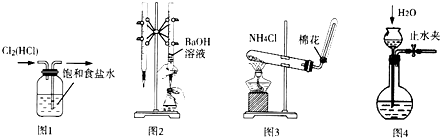
| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
 .
. 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).