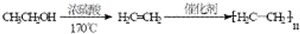题目内容
6.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 标准状况下,22.4L庚烷的分子数约为NA | |
| B. | 1L 0.1mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA | |
| C. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| D. | 50mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、标况下庚烷为液态;
B、S2-在溶液中能水解为HS-和H2S,根据物料守恒来分析;
C、H218O与D2O的摩尔质量均为20g/mol;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应.
解答 解:A、标况下庚烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、S2-在溶液中能水解为HS-和H2S,根据物料守恒可知,溶液中的S2-、HS-和H2S个数共为0.1NA个,故B错误;
C、H218O与D2O的摩尔质量均为20g/mol,故4.0g混合物的物质的量为0.2mol,而两者均含10个中子,故0.2mol混合物中含2NA个中子,故C正确;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则转移的电子数小于0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
20. 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO?CH3OCH3+CO2的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol.
(2)已知一些共价键的键能如下:
运用反应①计算一氧化碳中碳氧共价键的键能1070kJ•mol-1.
(3)在250℃恒容密闭容器中,下列事实可以说明反应③已达平衡的是(填选项字母)BC.
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(4)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.042.
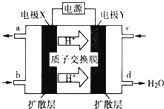
(5)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示.
①氧气应从C处通入,电极Y为正极,发生的电极反应式为O2+4e-+4H+═2H2O;
②二甲醚(CH3)2O应从b处加入,电极X上发生的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
③电池在放电过程中,电极X周围溶液的pH减小 (填“增大”“减小”或“不变”).
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO?CH3OCH3+CO2的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol.
(2)已知一些共价键的键能如下:
| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
(3)在250℃恒容密闭容器中,下列事实可以说明反应③已达平衡的是(填选项字母)BC.
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(4)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.042.
(5)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示.
①氧气应从C处通入,电极Y为正极,发生的电极反应式为O2+4e-+4H+═2H2O;
②二甲醚(CH3)2O应从b处加入,电极X上发生的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
③电池在放电过程中,电极X周围溶液的pH减小 (填“增大”“减小”或“不变”).
1.用如表实验方案及所选玻璃容器(非玻璃容器任选)能够实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去乙酸乙酯中少量乙醇 | 将混合物中加水,多次水洗分液 | 分液漏斗、烧杯 |
| B | 证明HClO和醋酸的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 由FeCl3溶液得到FeCl3•6H2O晶体 | 向FeCl3溶液中不断滴加盐酸,加热,至有晶体 出现 | 酒精灯、表面皿、玻璃棒 |
| D | 配制1L 0.1mol•L-1的CuSO4溶液 | 将16gCuSO4•5H2O溶于水配成1000mL溶液 | 烧杯、量筒、玻璃棒、1000mL容量瓶 |
| A. | A | B. | B | C. | C | D. | D |
11.下列属于放热反应的是( )
| A. | 液态水气化 | B. | Al和Fe3O4的反应 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
18. 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH═(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH═Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如图,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如表:
| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.

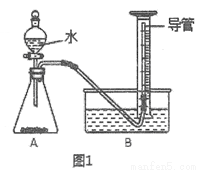
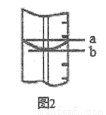
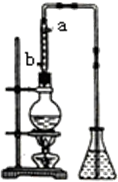 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
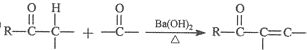
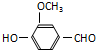 ,有关反应过程如下:
,有关反应过程如下: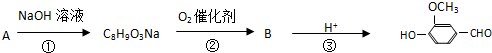
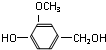 B
B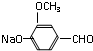 .
.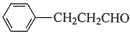 的合成路线流程图.(无机试剂任用,路线流程图示例如下:
的合成路线流程图.(无机试剂任用,路线流程图示例如下: