题目内容
5.钒及其化合物广泛应用于催化剂和新型电池等.工业上以富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)为原料提取五氧化二钒的工艺流程如图所示:
(1)该工艺可循环利用的物质有NaCl、NH4Cl.
(2)焙烧炉中发生的主要反应化学方程式为2V2O5+4NaCl+O2=4NaVO3+2Cl2↑,焙烧炉中可用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠.用Na2CO3代替NaCl的优点是:无Cl2产生,不污染环境.
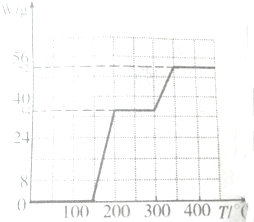
(3)234g固体偏钒酸钠在煅烧过程中,固体的质量减少值△W随温度变化的曲线如图所示.其分解过程中a,(NH4VO3的相对分子质量为117)
a、先分解失去NH3,再分解失去H2O
b、先分解失去H2O,再分解失去NH3
c、同时失去NH3和H2O
d、同时失去H2、N2和H2O
(4)为测定该产品的纯度,兴趣小组同学准确称取产品V2O5 2.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250ml溶液.取25.00ml溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00ml.离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O产品的纯度为91%.
(5)V2O5 具有强氧化性,能与盐酸反应生成Cl2和VO+.该反应的离子方程式为V2O5+4Cl-+6H+=2VO++2Cl2↑+3H2O.用V2O5、KMnO4分别于浓盐酸反应制取等量的Cl2时,消耗V2O5、KMnO4的物质的量之比为5:4.
分析 富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)加氧气和NaCl焙烧,生成含有杂质的偏钒酸钠,用水溶解,过滤,滤液中加氯化铵和硫酸生成偏钒酸铵和氯化钠,过滤,滤渣为偏钒酸铵,滤液为氯化钠溶液,煅烧偏钒酸铵生成氨气和五氧化二钒,氨气用盐酸吸收可以得到氯化铵;
(1)根据流程分析判断;
(2)焙烧时V2O5与NaCl、氧气反应生成偏钒酸钠和氯气;用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠和二氧化碳;
(3)根据NH4VO3在焙烧时质量变化的图象进行解答;
(4)已知离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O,根据H2C2O4的物质的量求出VO2+的物质的量,再求出V2O5的质量和质量分数;
(5)V2O5具有强氧化性,能与盐酸反应生成Cl2和VO+,根据得失电子守恒和原子守恒配平方程式;根据方程式计算.
解答 解:富钒炉渣(主要成分为V2O5、Fe2O3和SiO2等)加氧气和NaCl焙烧,生成含有杂质的偏钒酸钠,用水溶解,过滤,滤液中加氯化铵和硫酸生成偏钒酸铵和氯化钠,过滤,滤渣为偏钒酸铵,滤液为氯化钠溶液,煅烧偏钒酸铵生成氨气和五氧化二钒,氨气用盐酸吸收可以得到氯化铵;
(1)由流程分析可知,该工艺可循环利用的物质有NaCl、NH4Cl;
故答案为:NaCl、NH4Cl;
(2)焙烧时V2O5与NaCl、氧气反应生成偏钒酸钠和氯气,其反应的方程式为:2V2O5+4NaCl+O2=4NaVO3+2Cl2↑;用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠和二氧化碳,反应中没有氯气生成,不会污染环境;
故答案为:2V2O5+4NaCl+O2=4NaVO3+2Cl2↑;无Cl2产生,不污染环境;
(3)根据NH4VO3在焙烧变化的图象可知:
2NH4VO3═V2O5+2NH3↑+H2O
234g 34g 18g
减少值开始为0~34g,曲线到200℃时曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少18g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水,故a正确;
故答案为:a;
(4)准确称取产品V2O5 2.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250ml溶液.取25.00ml溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00ml,已知离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O,
则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,
所以250ml溶液中n(VO2+)=2×0.01L×0.1000mol/L×$\frac{250mL}{25mL}$=0.02mol,所以n(V2O5)=0.01mol,其质量为0.01mol×182g/mol=1.82g,
所以产品的纯度为$\frac{1.82}{2}$×100%=92%;
故答案为:92%;
(5)V2O5具有强氧化性,能与盐酸反应生成Cl2和VO+,其反应的离子方程式为:V2O5+4Cl-+6H+=2VO++2Cl2↑+3H2O;高锰酸钾与盐酸反应生成氯气方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,则分别生成1mol氯气消耗V2O5、KMnO4的物质的量之比为0.5mol:0.4mol=5:4;
故答案为:5:4.
点评 本题考查实验制备方案、氧化还原反应滴定及计算、物质的分离提纯、对条件与操作的分析评价,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )
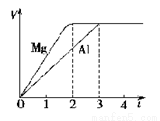
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
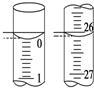
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:2H2(g)+CO(g)?CH3OH(g)△H=-90.0kJ.mol-1 ①
2CH3OH(g)?CH3OCH(g)+H2O (g)△H=-24.5kJ.mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.1kJ.mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO?CH3OCH3+CO2的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-245.6kJ/mol.
(2)已知一些共价键的键能如下:
| 化学键 | H-H | C-H | C-O | O-H |
| 键能(kJ.mol-1 | 436 | 414 | 326 | 464 |
(3)在250℃恒容密闭容器中,下列事实可以说明反应③已达平衡的是(填选项字母)BC.
A.容器内气体密度保持不变
B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1:1
D.该反应的平衡常数保持不变
(4)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.042.
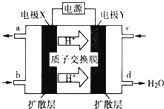
(5)绿色电源“二甲醚-氧气燃料电池”的工作原理如图所示.
①氧气应从C处通入,电极Y为正极,发生的电极反应式为O2+4e-+4H+═2H2O;
②二甲醚(CH3)2O应从b处加入,电极X上发生的电极反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
③电池在放电过程中,电极X周围溶液的pH减小 (填“增大”“减小”或“不变”).
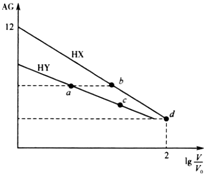 常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | a、b溶液中导电离子数目相等 | |
| B. | 水的电离程度:a<b<c | |
| C. | d点所示溶液的AG=8 | |
| D. | 与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点 |
| A. | 液态水气化 | B. | Al和Fe3O4的反应 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
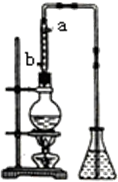 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).


