题目内容
用质量分数为98%,密度为1.84g?cm-3的浓硫酸配制l mol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取 mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取 mL浓硫酸;应选择 mL量筒(填5、10或50).
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是 .
(3)正确的操作顺序是(用序号填写)
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1)摇匀后,液面低于刻度线,没有再加水;
2)移液过程中,不小心溅出少量溶液;
3)定容时,如果俯视刻度线,配制的硫酸浓度将 .
①用量筒量取
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是
(3)正确的操作顺序是(用序号填写)
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1)摇匀后,液面低于刻度线,没有再加水;
2)移液过程中,不小心溅出少量溶液;
3)定容时,如果俯视刻度线,配制的硫酸浓度将
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据需要的浓硫酸的体积选择适合的量筒;
(2)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(4)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
| 1000ρw |
| M |
(2)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(4)根据c=
| n |
| V |
解答:
解:(1)浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设需要的浓硫酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×Vml×10-3=l mol/L×0.1L 解得:V=5.4mL;选择量筒的原则是“大而近”,故应选择10ml的量筒;故答案为:5.4;10;
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,一般用量筒来量取浓溶液,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故还需要100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(3)配制步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,故正确的操作顺序是①④③②⑤,故答案为:①④③②⑤;
(4)1)摇匀后,液面低于刻度线是由于在瓶塞和瓶口会沾留一部分溶液,没有再加水是正确的,故实际浓度不变,故答案为:不变;
2)移液过程中,不小心溅出少量溶液,会导致溶质损失,所配溶液浓度偏低,故答案为:偏低;
3)定容时,如果俯视刻度线,会导致溶液体积偏小,浓度偏高,故答案为:偏高.
| 1000ρw |
| M |
| 1000×1.84g/ml×98% |
| 98 |
18.4mol/L×Vml×10-3=l mol/L×0.1L 解得:V=5.4mL;选择量筒的原则是“大而近”,故应选择10ml的量筒;故答案为:5.4;10;
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,一般用量筒来量取浓溶液,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故还需要100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(3)配制步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,故正确的操作顺序是①④③②⑤,故答案为:①④③②⑤;
(4)1)摇匀后,液面低于刻度线是由于在瓶塞和瓶口会沾留一部分溶液,没有再加水是正确的,故实际浓度不变,故答案为:不变;
2)移液过程中,不小心溅出少量溶液,会导致溶质损失,所配溶液浓度偏低,故答案为:偏低;
3)定容时,如果俯视刻度线,会导致溶液体积偏小,浓度偏高,故答案为:偏高.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、10-3 mol?L-1的氨水与pH=3的硫酸等体积混合:c(SO42-)=c(NH4+)>c(OH-)=c(H+) |
| D、0.1mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH) |

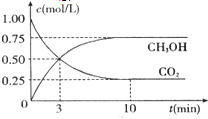 为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0
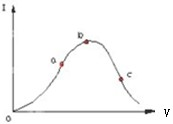 醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: