题目内容
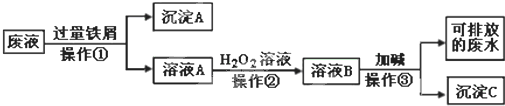
用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为 mL,将浓硫酸缓缓倒入盛水的烧杯中后 (填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中.
(2)若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
验时应选用的仪器有(填入编号) .
(3)定容时,若俯视液面,则所配溶液浓度 (填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应 .
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制.
(1)用量筒量取浓硫酸的体积应为
(2)若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
验时应选用的仪器有(填入编号)
(3)定容时,若俯视液面,则所配溶液浓度
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据浓硫酸稀释前后,溶质的物质的量不变和量筒的使用方法来回答;
(2)依据配制一定物质的量浓度溶液用的仪器解答;
(3)依据C=
进行误差分析.
(2)依据配制一定物质的量浓度溶液用的仪器解答;
(3)依据C=
| n |
| V |
解答:
解:(1)浓硫酸稀释前后,溶质的物质的量不变,设需要浓硫酸的体积是V,则18mol/L×V=0.1L×1.0mol/L,解得V=5.6mL,用量筒量取液体,不能洗涤,否则所量取液体的量偏大;
故答案为:5.6;不应;
(2)配制一定物质的量浓度的溶液所需的仪器:天平、烧杯、胶头滴管、玻璃棒、量筒、一定规格的容量瓶,烧杯 玻璃棒 胶头滴管,
故答案为:CEFGH;
(3)由C=
可知:定容时,若俯视液面,导致所加蒸馏水偏少,所配溶液体积V偏小,则浓度偏高,若不小心加水超过了容量瓶刻度线,应重新配制;
故答案为:偏高;C.
故答案为:5.6;不应;
(2)配制一定物质的量浓度的溶液所需的仪器:天平、烧杯、胶头滴管、玻璃棒、量筒、一定规格的容量瓶,烧杯 玻璃棒 胶头滴管,
故答案为:CEFGH;
(3)由C=
| n |
| V |
故答案为:偏高;C.
点评:本题考查学生配制一定物质的量浓度的溶液以及仪器的使用方面的知识,可以根据所学知识进行回答,注意误差分析是难点,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
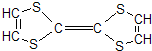 用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如图所示.关于其性质的描述不正确的是( )| A、能使溴水和酸性KMnO4溶液褪色 |
| B、1mol该物质可与3molH2完全加成 |
| C、该物质在空气燃烧产生刺激性气体 |
| D、该物质属于烯烃 |
硅橡胶的主要成分如图所示,是由二氯二甲基硅烷经两种反应制成的,这两种反应是( )


| A、加聚 | B、水解 | C、缩聚 | D、氧化 |
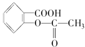 ,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)
,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)