题目内容
13.对于300mL 1mol•L-1盐酸与铁片的反应,采取下列措施:①升高温度
②改用100mL 3mol•L-1盐酸
③再加300mL 1mol•L-1盐酸
④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸
其中能使反应速率加快的是( )
| A. | ①②④ | B. | ①③④ | C. | ①②③④ | D. | ①②③⑤ |
分析 若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
解答 解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②改用100mL 3mol/L盐酸,酸的浓度增大,反应速率加快,故正确;
③用300mL 1mol/L盐酸,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故选A.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合运用的考查,难度不大,注意相关基础知识的积累,把握影响化学反应速率的因素.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
3.下列物质可以发生钝化反应的是( )
| A. | Fe和浓硫酸 | B. | Fe和浓硝酸 | C. | Al和浓硫酸 | D. | Al和浓硝酸 |
4.甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( )


| A. | 将甲的溶液从t2℃降到t1℃,其溶质的质量分数一定减小 | |
| B. | t2℃时,甲、乙的饱和溶液各100g,其溶质的质量一定相等 | |
| C. | 当温度高于0℃而低于t1℃时,乙的溶解度比甲的溶解度大 | |
| D. | t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液 |
1.下列关于12C和13C说法正确的是( )
| A. | 两者互为同位素 | B. | 两者属于不同的元素 | ||
| C. | 两者属于同一种核素 | D. | 两者互为同素异形体 |
8.硫元素在周期表中的位置是( )
| A. | 第二周期 VIA族 | B. | 第三周期 VIA族 | C. | 第二周期ⅦA族 | D. | 第三周期 IVA族 |
18.H2和CO2在催化剂作用下能缓慢地起反应生成CH3OH和H2O,对此反应,下列叙述中正确的是( )
| A. | 使用催化剂不能改变反应速率 | B. | 降低压强能使反应速率加快 | ||
| C. | 改变压强对反应速率没有影响 | D. | 升高温度能加快反应速率 |
5.下列有关基本营养物质的说法中,错误的是( )
| A. | 淀粉遇碘化钾溶液变蓝 | |
| B. | 葡萄糖和果糖互为同分异构体 | |
| C. | 利用油脂在碱性条件下水解可制取肥皂 | |
| D. | 用灼烧并闻气味的方法鉴别羊毛织物和棉织物 |
3.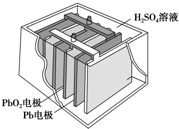 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
 汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
汽车的启动电源常用铅蓄电池.其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | B. | SO42-向Pb极移动 | ||
| C. | PbO2得电子,被氧化 | D. | 电池放电时,溶液酸性增强 |