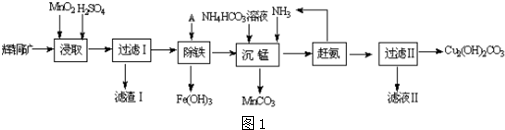
题目内容
3.下列物质可以发生钝化反应的是( )| A. | Fe和浓硫酸 | B. | Fe和浓硝酸 | C. | Al和浓硫酸 | D. | Al和浓硝酸 |
分析 硝酸、浓硫酸都具有强氧化性,能与金属发生氧化还原反应,而常温下,Fe、Al遇浓硫酸或浓硝酸发生钝化,阻止反应进一步发生,以此来解答.
解答 解:浓硝酸、浓硫酸都具有强氧化性,在常温下,金属铁或金属铝遇到浓硝酸会在金属表面形成致密的氧化膜发生钝化,
A.常温下Fe和浓硫酸表面形成致密的氧化膜,发生钝化反应,故A正确;
B.常温下Fe和浓硝酸金属表面形成致密的氧化膜,发生钝化反应,故B正确;
C.常温下Al和浓硫酸金属表面形成致密的氧化膜,发生钝化反应,故C正确;
D.常温下金属Al与浓硝酸发生钝化反应,会在金属表面形成致密的氧化膜,故D正确;
故选ABCD.
点评 本题考查金属钝化的有关知识,明确发生钝化的金属只有Al、Fe,酸为浓硝酸、浓硫酸是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
4.下列离子在指定溶液中可能大量共存的是( )
| A. | 中性溶液中:Fe3+、Cl-、Na+、SO42- | |
| B. | pH=1的溶液中:NO3-、K+、CO32-、Br- | |
| C. | 紫色石蕊呈蓝色的溶液中:S2-、Na+、SO32-、I- | |
| D. | 焰色反应为黄色的溶液中:CH3COO-、NH4+、AlO2-、Ba2+ |
11.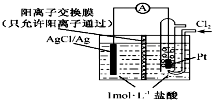 某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
 某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )
某原电池装置如右图所示,电池总反应为2Ag+Cl2═2AgCl.已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒.下列说法正确的是( )| A. | 正极反应为AgCl+e-=Ag+Cl- | |
| B. | 电池工作时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用KCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.2 mol e-时,交换膜左侧溶液中约减少0.4 mol离子 |
18.下列说法正确的是( )
| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
15.用标准盐酸溶液滴定未知浓度的氢氧化钠溶液,使得所测氢氧化钠溶液的浓度偏高的错误操作是( )
| A. | 中和滴定达中点时俯视滴定管内液面度数 | |
| B. | 碱式滴定管用蒸馏水洗净后立即装待测溶液来滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 | |
| D. | 把配好的标准溶液倒入刚用蒸馏水洗净的锥形瓶中然后用来滴定 |
12.化学与人类生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 人们可以把放热反应释放的能量转化为其它可利用的能量,而吸热反应没有利用价值 | |
| B. | 太阳能热水器、沼气的使用、玉米制乙醇都涉及生物质能的利用 | |
| C. | 地球上最基本的能源是化学能 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |