题目内容
8.硫元素在周期表中的位置是( )| A. | 第二周期 VIA族 | B. | 第三周期 VIA族 | C. | 第二周期ⅦA族 | D. | 第三周期 IVA族 |
分析 S元素的原子序数=核外电子总数=16,核外含有3个电子层,最外层含有6个电子,据此可判断硫元素在元素周期表中的位置.
解答 解:硫元素的原子序数、核外电子总数为16,其核外电子层数为3,最外层电子数为6,则S元素在周期表中的位置为:第三周期 VIA族,
故选B.
点评 本题考查了元素周期表结构及其应用,题目难度不大,明确原子结构与元素周期表的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
16.mmol C2H4跟 nmol H2在密闭容器中反应,生成pmol C2H6.将反应后的混合气体完全燃烧,生成CO2和H2O,所需氧气的物质的量是( )
| A. | 3.5 pmol | B. | (3m+$\frac{n}{2}$-3p)mol | C. | (3m+$\frac{n}{2}$)mol | D. | (3m+n)mol |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2L氟化氢中含有分子的数目为0.5NA | |
| B. | 常温下a克某烷烃(CnH2n+2)中含有共用电子对数目为$\frac{a}{14n+2}$(3n+1)NA | |
| C. | 56g 聚乙烯中含有碳碳双键的数目为2NA | |
| D. | 常温下,0.2mol/L的FeCl3溶液中含Cl-数目为0.6NA |
13.对于300mL 1mol•L-1盐酸与铁片的反应,采取下列措施:
①升高温度
②改用100mL 3mol•L-1盐酸
③再加300mL 1mol•L-1盐酸
④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸
其中能使反应速率加快的是( )
①升高温度
②改用100mL 3mol•L-1盐酸
③再加300mL 1mol•L-1盐酸
④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸
其中能使反应速率加快的是( )
| A. | ①②④ | B. | ①③④ | C. | ①②③④ | D. | ①②③⑤ |
20.下列说法正确的是(NA 表示阿伏加德罗常数的值)( )
| A. | 16.9 克过氧化钡(BaO2)固体中阴阳离子总数为0.3NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g 乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol 甲基与1mol 羟基所含电子数均为10 NA 个 |
17.下列图示与对应的叙述相符的是( )

| A. | 图1表示0.1000mol•L-1NaOH溶液滴定20.00ml 0.1000 mol•L-1醋酸溶液得到滴定曲线 | |
| B. | 图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2 | |
| C. | 图3在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系中,纵坐标表示O2的转化率 | |
| D. | 由图4所示曲线可知,酶催化比化学催化的效果好 |
18.有关营养物质的说法正确的是( )
| A. | 在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 | |
| B. | 纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 | |
| C. | 油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 | |
| D. | 蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 |
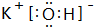 ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl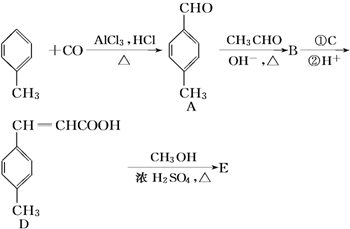
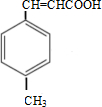 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$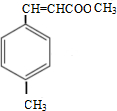 +H2O
+H2O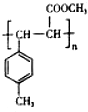 .
.